Статья опубликована в рамках: XI Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 02 октября 2012 г.)
Наука: Медицина
Секция: Пульмонология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АНАЛИЗ КЛИНИКО-ИММУНОЛОГИЧЕСКИХ И ГЕНЕТИЧЕСКИХ ФАКТОРОВ ТЯЖЕЛОЙ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Сабитова Ольга Николаевна
аспирант, ОмГМА, г. Омск
E-mail: olleus@mail.ru
Внебольничная пневмония (ВП) — острое заболевание, возникшее вне стационара, или диагностированное в первые 48 ч от момента госпитализации, и сопровождающееся симптомами инфекции нижних отделов дыхательных путей и рентгенологическими признаками «свежих» очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы [11]. Внебольничная пневмония (ВП) относится к наиболее распространенным острым инфекционным заболеваниям. Согласно расчетам истинная заболеваемость составляет 14—15 %, а общее число больных ежегодно превышает 1,5 млн человек [9]. Летальность при внебольничной пневмонии различается в зависимости от тяжести заболевания и составляет от 1 % у амбулаторных больных до 54 % у пациентов, госпитализированных в отделение реанимации и интенсивной терапии и в среднем составляет 10 % [10]. Оценка тяжести состояния необходима для определения тактики и места лечения больного. Своевременная и точная оценка факторов риска тяжелой пневмонии позволит правильно и адекватно выбрать место лечения и тактику ведения больного. Наибольшее влияние на развитие тяжелого течение заболевания по данным ряда авторов оказывают условия возникновения пневмонии, этиология, сопутствующая патология, возраст и иммунокомпетентность больного [9, 10, 11].
В реализации воспаления в легочной ткани первым в ответ на внедрение патогенна реагирует фактор некроза опухоли-альфа (ФНОα), который способствует рекрутированию эффекторных клеток в очаг воспаления [5], его уровень отражает активацию иммунокомпетентных клеток в ответ на воспаление и оказывается повышенным при тяжелой пневмонии [1, 3, 4, 12]. Известно, что уровень ФНОα закреплен генетически. Ген ФНОα расположен на 6-й хромосоме и имеет несколько полиморфных участков. Наибольшее влияние на продукцию кодируемого цитокина оказывает его полиморфизм -308 G/A [6, 8, 13]. Остается неясным является ли повышенная продукция ФНОα при пневмонии первичной, генетически закрепленной, приводя к цитокин-опосредованному повреждению легочной ткани и, как следствие, тяжелой пневмонии или его высокий уровень в крови является отражением выраженного воспаления при тяжелой пневмонии.
Цель исследования: изучить клинические (возраст, пол, сопутствующая патология, этиология), иммунологические и молекулярно-генетические факторы риска тяжелой ВП.
Материалы и методы
Нами были обследованы 89 пациентов (52 мужчины и 37 женщин), средний возраст — 48,5 (33,5; 59) лет, получавших стационарное лечение в пульмонологическом отделении ГУЗОО ОКБ в 2009 г. Для подтверждения диагноза пневмонии использовались стандартные клинико-рентгенологические и лабораторные критерии [9]. Все пациенты дали письменное добровольное информированное согласие на участие в исследовании. Работа одобрена этическим комитетом. Из исследования были исключены пациенты с подтвержденной ВИЧ-инфекцией, больные, получавшие терапию иммунодепрессантами, беременные женщины. Все пациенты были разделены на 2 группы. 1 группу составили 55 человек с нетяжелой ВП, во 2 группу вошли 34 пациента с тяжелой ВП.
Определение уровня ФНОα в сыворотке крови осуществлялось с помощью наборов реагентов Прокон, Протиновый контур (г. Санкт-Петербург) в 1-е сутки госпитализации (n=71). Определение полиморфизма гена ФНОα -308 G/A (n=89) проведено методом полимеразной цепной реакции. Распределение частот генотипов соответствовало закону Харди-Вайнберга (χ2=0,16, р=0,69). Специальные методы исследования проведены на базе ЦНИЛ ОмГМА.
Для оценки статистически значимых различий полученных данных использовали непараметрический критерий Манна-Уитни, χ2. Количественные данные представлены в виде Ме (Q25; Q75), где Ме — медиана, Q25 и Q75 — верхний и нижний квартили. Критический уровень значимости принимался равным 0,05.
Результаты
В соответствии с рекомендациями Российского Респираторного общества [9] ВП была отнесена к тяжелой при наличии хотя бы одного из нижеперечисленных критериев: острая дыхательная недостаточность, гипотензия, двух- или многодолевое поражение, нарушение сознания, внелегочный очаг инфекции, лейкопения, гипоксемия, гемоглобин <100 г/л, гематокрит <30 %, острая почечная недостаточность и закономерно сопровождалась более выраженными клиническими, лабораторными и рентгенологически изменениями.
Тяжелая ВП встречалась преимущественно у пациентов мужского пола (73,5 % против 49,1 %, р<0,05). Исследуемые были сопоставимы по возрасту и времени обращения к врачу. Легочное воспаление чаще развивалось на фоне хронической обструктивной болезни легких (ХОБЛ), которая наблюдалась у половины обследованных больных. Как видно из таблицы 1 наиболее распространенным заболеваниями, встречающимися с одинаковой частотой как в первой, так и во второй группах больных были ишемическая болезнь сердца и гипертоническая болезнь. Реже в обеих группах встречались хроническая почечная недостаточность, ожирение, раки различных локализаций, сахарный диабет 2 типа и застойная сердечная недостаточность. ХОБЛ достоверно чаще наблюдалась у пациентов тяжелого течения (p<0,01). Известно, что патологические изменения при ХОБЛ, связаны с ограничение дыхательных движений, нарушением дренажной функции, малой эффективностью реснитчатого эпителия, частым развитием ателектазов в результате закупорки мелких бронхов, увеличением роли аутоинфекции, ослаблением неспецифической защиты бронхиального дерева, нарушением микроциркуляции [7].
Таблица 1.
Структура сопутствующей патологии у больных ВП, абс. (%)
Заболевания |
Всего |
Нетяжелое течение |
Тяжелое течение |
Хроническая обструктивная болезнь легких |
44 (49,4) |
21 (38,2) |
23 (67,6)* |
Ишемическая болезнь сердца |
26 (29,2) |
18 (32,7) |
8 (23,5) |
Гипертоническая болезнь |
33 (37,1) |
25 (45,5) |
8 (23,5) |
Застойная сердечная недостаточность |
2 (2,2) |
2 (3,6) |
0 |
Хроническая почечная недостаточность |
16 (18) |
9 (16,3) |
7 (20,6) |
Злокачественые новообразования |
6 (6,7) |
4 (7,3) |
2 (5,9) |
Сахарный диабет |
5 (5,6) |
3 (5,5 ) |
2 (5,9) |
Ожирение |
17 (19,1) |
11 (20) |
6 (17,6) |
Примечание: достоверность рассчитана в группах тяжелого и нетяжелого течения с использованием критерия χ2 (p<0,01).
У 40,5 % больных были выявлены осложнения заболевания (рисунок 1). Наиболее частым осложнением пневмонии являлся плевральный выпот — 39,3 %. Двусторонний выпот наблюдался только у пациентов 2 группы (n=4). У 7 (7,9 %) больных наблюдалась деструктивная пневмония. Абсцедирование зоны пневмонической инфильтрации имело место у 4 пациентов (4,5 %).
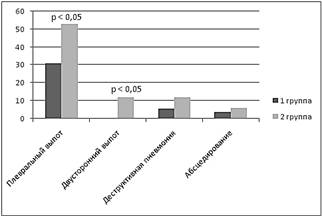
Рисунок 1. Осложнения ВП (%)
Для установления этиологии ВП проведено бактериологическое исследование мокроты. Результаты микробиологического исследования трактовались как диагностически значимые при выделении культуры возбудителя ≥ 106 КОЕ/мл [2]. В результате проведенного исследования из 89 пациентов возбудитель был верифицирован только у 48 пациентов, что составило 53,9 %. При этом в 34,8 % случаев ВП вызывал один причинно-значимый микроорганизм, ассоциации микроорганизмов выделены у15,7 % больных. В общей структуре возбудителей (всего 65 штаммов) доля грамположительных микроорганизмов составила 44,9 %, грамнегативных 16,9 %. Достаточно высокой в общей структуре возбудителей пневмонии оказалась доля грибковой флоры — 11,2 %. Мы объясняем это неадекватным использованием антибактериальных препаратов на догоспитальном этапе.
Среди грамположительной флоры наиболее актуальным возбудителем был Streptococcus pneumoniae, его доля среди всех выявленных возбудителей — 35,4 %. Вторым по частоте возбудителем являлся энетрококки 15,4 % , реже обнаруживали Staphylococcus aureus — 9,2 %, Streptococcus viridians — 1,5 %. Грамотрицательная флора представлена энтеробактериями (Klebsiella pneumonia, Enterobacter aerogenes, Citrobacter). — 13,8 %, Pseudomonas aeruginosa — 6,2 % и бактерии рода Neiserria в 3,1 % случаев.
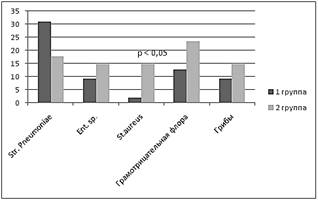
Рисунок 2. Этиологический состав у пациентов с различным течением ВП (%)
Состав этиологически значимых агентов при обычном и тяжелом течении внебольничной пневмонии различался (рисунок 2). У пациентов с нетяжелым течением заболевания ведущую роль в этиологии заболевания играли Streptococcus pneumoniae (30,9 % против 17,6 % во 2 группе; р>0,05), что отражало общую тенденции в отношении данных возбудителей [9]. В то же время тяжелую пневмонию достоверно чаще вызывал Staphylococcus aureus (14,7 % против 1,8 % в 1 группе наблюдения; р<0,05 ). Также обращал внимание тот факт, что при тяжелом течении пневмонии чаще выявлялись ассоциации микроорганизмов и грамотрицательная флора (по 23,5 %, тогда как при обычном течении заболевания — по 12,7 % (р>0,05).
Иммунологическое исследование показало двоякую роль ФНОα в патогенезе ВП. Несмотря на то, что уровень цитокина в группах статистически значимо не отличался, его гиперпродукция более 50 пг/мл сопровождалась тяжелым и осложненным течением заболевания (таблица 2). Высокий уровень цитокина может приводить к цитокин-опосредованному повреждению тканей и утяжелению заболевания [3]. Причиной высокого уровня ФНОα могла быть грамотрицательная флора, при которой уровень цитокина составил (22,4 против 8,15 пг/мл, р=0,01). Низкий уровень ФНОα наблюдался в основном у пациентов старше 55 лет (9,5 против 13,75 пг/мл у пациентов моложе 55 лет, р>0,05). Проведение корреляционного анализа подтвердило обратную корреляционную связь с возрастом (r=–0,234, р<0,05). Сопутствующая патология не оказала существенно значимого влияния на уровень ФНОα.
Таблица 2.
Клиническая характеристика больных с различным уровнем ФНОα
Признаки |
ФНОα<50 пг/мл (n=63) |
ФНОα>50 пг/мл (n=8) |
р |
Температура тела, оС ЧДД в мин. ЧСС в мин. |
38,3 (38; 39) 24 (22; 26) 95 (84; 100) |
38,9 (37,6; 39,7) 25 (22; 27) 97 (88; 100) |
>0,05 >0,05 >0,05 |
Тяжелая, абс. (%) Осложненная, абс. (%) Выпот, абс. (%) двусторонний Деструкция, абс. (%) |
25 (39,7) 25 (39,7) 22 (34,9) 3 (4,8) 7 (11,1) |
7 (87,5) 6 (75) 7 (87,5) 3 (37,5 ) 1 (12,5) |
0,011 >0,05 0,004 0,0017 >0,05 |
В нашем исследовании оценивалась уровень сывороточного цитокина в зависимости от полиморфизма гена ФНОα -308 G/A и выявлено существенно повышение содержания ФНОα при наличии аллеля А в исследуемом локусе (рисунок 3).
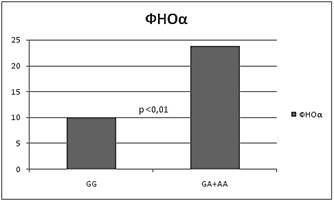
Рисунок 3. Уровень ФНОα у пациентов-носителей различных генотипов гена ФНОα -308 G/A (пг/мл)
Среди пациентов с различным течением заболевания отмечались отличия в частоте генотипов (рисунок 4). Генотипы GA+AA чаще наблюдались при тяжелом течении ВП (58,8 % против 30,9 %, р<0,01).
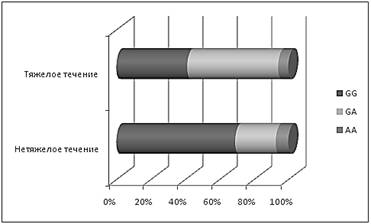
Рисунок 4. Распределение частот генотипов гена ФНОα -308 G/A среди пациентов с различным течением заболевания (%)
Таким образом:
1.Тяжелая пневмония была обусловлена как этиологическими факторами (Staphylococcus aureus), так и факторами со стороны пациента: пол, развитие заболевание на фоне ХОБЛ, и сочеталась с осложненным течением ВП.
2.Уровень ФНОα определялся этиологией заболевания, возрастом пациента и генетическими особенностями. Гиперпродукция ФНОα приводила к тяжелой и осложненной ВП.
3.Наличие мутантного аллеля А гена -308 ФНОα приводило к увеличению кодируемого цитокина и являлось независимым фактором риска тяжелого течения ВП.
Список литературы:
1.Агаджанян В.В. Влияние факторов воспаления на течение внебольничной пневмонии // Цитокины и воспаление. — 2006. — Т. 5, № 3. — С. 16 —20.
2.Зубков М.Н. Практической руководство по клинической микробиологии и антимикробной терапии. М.: Изд-во МГУП, 2002. — 272 с.
3.Красников В. Е. Патогенетическая роль нарушений в системе цитокинов при инфекционно-воспалительных заболеваниях // Тихоокеанский медицинский журнал. — 2008. — № 3. — С. 24—29.
4.Кукес В.Г. Критерии синдрома системного воспалительного ответа у больных тяжелой пневмонией // Пульмонология. — 2003. — № 4. — С. 15—22.
5.Пальцев М.А. Цитокины. От теории к практике // Вестник Российской академии наук. — 1996. — Т. 66, № 12. — С. 1079—1084.
6.Рыдловская А.В. Функциональный полиморфизм гена TNF-α и патология // Цитокины и воспаление. — 2005. — Т. 4, № 3. — С. 4—10.
7.Сильвестров В.П. Пневмония. М.: Медицина, 1987. — 248 с.
8.Симбирцев А.С., Громова А.Ю. Функциональный полиморфизм генов регуляторных молекул воспаления // Цитокины и воспаление. — 2005. — Т. 4, № 1, с. 3—10.
9.Чучалин А.Г. Респираторная медицина. М., 2007.
10.Яковлев С.В. Моксифлоксацин при тяжелой пневмонии: первая возможность монотерапии? // Пульмонология. — 2002. — № 3. — С. 123—128.
11.Mandell L.A. Infectious diseases society of America/American Thoracic Society Consensus guidelines on the management of community—acquired pneumonia in adults // Clinical infectious diseases. 2007 — № 44. — P. 27—72.
12.Puren A.J. Patterns of Cytokine Expression in Community-Acquired Pneumonia // Chest. — 1995. — Vol. 107, № 5. — Р. 1342—1349.
13.Qidway T. Tumour necrosis factor gene polymorphism and disease prevalence // Scand J Immunol. — 2011. — 74 (6). — Р. 522—547.
дипломов


Оставить комментарий