Статья опубликована в рамках: IX Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 06 августа 2012 г.)
Наука: Медицина
Секция: Фармацевтическая химия, фармакогнозия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
АКТУАЛЬНЫЕ ВОПРОСЫ КЛАССИФИКАЦИИ ЛЕКАРСТВЕННЫХ ФОРМ ДЛЯ ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ
Лавренчук Руслан Александрович
научный сотрудник Отдела государственной фармакопеи и фармакопейного анализа
Центра фармакопеи и международного сотрудничества
ФГБУ «Научный центр средств медицинского применения»
Министерства здравоохранения и социального развития
Российской Федерации
(ФГБУ «НЦЭСМП» Минздравсоцразвития России), г. Москва
E-mail: Lavrenchuk@regmed.ru
Сакаева Ирина Вячеславовна
канд. фармацевт. наук, заместитель генерального директора по экспертизе ЛС ФГБУ «НЦЭСМП»
Минздравсоцразвития России, г. Москва
E-mail: Sakaeva@regmed.ru
Саканян Елена Ивановна
д-р фармацевт. наук, профессор, директор Центра фармакопеи и международного сотрудничества ФГБУ «НЦЭСМП» Минздравсоцразвития России, г. Москва
E-mail: Sakanjan@regmed.ru
Лекарственные формы для парентерального применения (ЛФП) занимают значительную долю фармацевтического рынка и играют огромную роль в терапии самых различных заболеваний. В связи с особенностями путей введения (введение лекарственного препарата под кожу, внутримышечно, внутрисосудисто и др.), помимо обычных требований к качеству, позволяющих установить подлинность, чистоту, количественное содержание препарата, предъявляются требования, характеризующие непосредственно лекарственную форму (ЛФ), а именно: стерильность, стабильность, отсутствие пирогенов или бактериальных эндотоксинов и др.
В настоящее время требования, предъявляемые к качеству ЛФП, представлены в ОФС «Лекарственные средства для парентерального применения» Государственной фармакопеи СССР XI издания (ГФ XI), в ОСТе 91500.05.001-00 «Отраслевой стандарт. Стандарты качества лекарственных средств. Основные положения» (ОСТ) и некоторых ОФС 1 части Государственной фармакопеи Российской федерации XII издания (ГФ XII) [1, 2, 3].
Ведущими мировыми стандартами качества ЛФ, в том числе и для парентерального применения, являются соответствующие монографии Международной (МФ), Европейской (ЕФ) и Японской Фармакопей (ЯФ), а также Фармакопеи США (ФСША). Каждая из них предлагает свою классификацию ЛФП (табл. 1).
Таблица 1.
Перечень ЛФП, представленных в отечественной и зарубежных фармакопеях, ОСТ и Государственном реестре лекарственных средств (ГРЛС) Минздрава РФ
|
№ п/п |
Наименование ЛФ |
Отечественные нормативные документы |
Ведущие зарубежные фармакопеи |
ГРЛС |
|||||
|
ГФ XI |
ОСТ |
ЕФ |
ФСША |
ЯФ |
МФ |
оНД |
зНД |
||
|
1. |
Раствор для инъекций |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
2. |
Суспензия |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
3. |
Эмульсия |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
4. |
Раствор для инфузий |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
5. |
Эмульсия |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
6. |
Концентрат для приготовления жидких инъекционных лекарственных препаратов (ЛП) |
- |
- |
+ |
- |
+ |
- |
+ |
+ |
|
7. |
Концентрат для приготовления жидких |
- |
- |
+ |
- |
+ |
- |
+ |
+ |
|
8. |
Гель для инъекций |
- |
- |
+ |
- |
- |
- |
- |
+ |
|
9. |
Порошок для приготовления парентеральных ЛП |
- |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
10. |
Лиофилизат для приготовления парентеральных ЛП |
- |
- |
Описан как порошок |
- |
+ |
Описан как порошок |
+ |
+ |
|
11. |
Имплантат |
- |
- |
+ |
+ |
+ |
+ |
+ |
+ |
Примечания.
1. оНД — нормативная документация отечественных производителей; зНД — нормативная документация зарубежных производителей.
2. К «растворам для инъекций» отнесены лекарственные препараты, включенные в ГРЛС, в таких ЛФ, как раствор для внутривенного, внутриартериального, внутримышечного, внутрипузырного, парабульбарного, подкожного, внутрикоронарного, субконъюнктивального, интраамниального и интратекального введения.
В соответствии с классификацией, приведённой в монографии «Парентеральные препараты» МФ, выделяют жидкие инъекционные ЛФ (сюда относятся растворы, эмульсии и суспензии), жидкие инфузионные ЛФ (растворы и эмульсии), порошки для приготовления жидких инъекционных или инфузионных ЛФ и имплантаты [7].
Классификация ЛФП, приведённая в ЕФ во многом схожа с таковой в МФ. В ЕФ дополнительно выделяют гели для инъекций и концентраты для приготовления инъекционных и инфузионных ЛФ [6].
В соответствии с классификацией, приведённой в монографии ФСША «Инъекции» <1>, выделяются ЛФ для инъекций (сюда относятся и растворы, и жидкие действующие вещества как таковые), твёрдые ЛФ для приготовления ЛФ для инъекций, эмульсии для инъекций, суспензии для инъекций, ЛФ для приготовления суспензии для инъекций. При этом имплантаты описаны в отдельной монографии, а гели для парентерального введения вскользь упоминаются в разделе «Гели» монографии «Фармацевтические дозированные формы» <1151> [9].
Японская фармакопея (ЯФ) не приводит классификации ЛФП. Данное в этой фармакопее определение ЛФ для инъекций распространяется на ЛФ для парентеральных инфузий, имплантаты, ЛФ для инъекций с пролонгированным высвобождением, порошки и лиофилизаты для приготовления инъекционных ЛФ [8].
В ГФ XI приведена классификация ЛФП по агрегатному состоянию (жидкие и твёрдые), по дисперсным свойствам жидких ЛП (растворы, суспензии и эмульсии), по объёму введения (инъекционные и инфузионные) [2].
Помимо перечисленных, существует другая общепризнанная классификация — анатомо-терапевтическая-химическая классификация ВОЗ (АТХ). В соответствии с разделом «В05 Кровезаменители и растворы для перфузии» АТХ выделены следующие группы препаратов: кровь и препараты крови, внутривенные растворы (растворы для парентерального питания, растворы влияющие на водно-электролитный баланс, растворы с осмодиуретическим действием), ирригационные растворы, растворы для перитонеального диализа, добавки к растворам для внутривенного введения (растворы электролитов, аминокислот, витаминов и другие растворы), гемодиализаты и гемофильтраты.
Кроме того, в литературных источниках встречается описание классификаций ЛФ по агрегатному состоянию, типу дисперсной системы, пути и способу введения, особенностям дозировки, по возрасту пациентов, характеру воздействия на организм [5].
Частные фармакопейные статьи на препараты для парентерального применения в отечественных нормативных документах приведены лишь в Государственной фармакопее СССР X издания. Между тем, ЯФ, ФСША и МФ содержат такие частные статьи. В настоящее время рассматривается вопрос о введении частных статей в ЕФ.
Следует отметить, что правильное определение классификационной подгруппы, к которой относится та или иная ЛФ, позволяет решить многие задачи, в том числе определить особенности контроля качества ЛП, представленного в данной лекарственной форме.
К основным классификациям, определяющим различия в подходах к стандартизации ЛФП, относятся дисперсологическая и классификация по объёму введения. Это обусловлено тем, что они характеризуют одновременно и физико-химические свойства лекарственного препарата, и особенности технологии получения. На их основе, а также в результате проведённого анализа отечественных и зарубежных нормативных документов, литературных источников, нами предложена объединённая классификация ЛФП, отражающая структуру изучаемой группы ЛФ (рис.1).
В соответствии с приведённой схемой можно выделить показатели качества, относящиеся ко всей группе ЛФП, затем относящиеся к жидким, твёрдым и ЛФП для имплантации, и далее к их конкретным разновидностям.
К обязательным требованиям для всех ЛФП относятся стерильность, стабильность, отсутствие бактериальных эндотоксинов или пирогенов. Выполнение этих требований контролируется введением необходимых показателей качества — «Стерильность», «Бактериальные эндотоксины» или «Пирогенность». Оценка стабильности должна проводиться по количественному содержанию действующих веществ и стабилизаторов.
Все суспензии, эмульсии, а также твёрдые ЛФП должны выдерживать требования соответствующих общих фармакопейных статей (ОФС «Суспензии», «Эмульсии», «Порошки», «Мази»).
Во всех жидких ЛФП определяют наличие механических включений (видимых и невидимых), извлекаемый объём и рН (в эмульсиях и суспензиях при необходимости). Для растворов определяют прозрачность и цветность. Для вязких растворов определяют плотность или вязкость. В эмульсиях для инъекций не должно быть признаков фазового расслоения, или они должны исчезать после взбалтывания. Кроме того, в эмульсиях для внутрисосудистого введения необходимо контролировать размер частиц (глобул) эмульсии. Суспензии для инъекций также контролируют по показателю «Размер частиц».
Твёрдые ЛФП и ЛФП для имплантации, должны выдерживать испытания «Однородность дозирования». Полученные из твёрдых ЛФП растворы и суспензии должны выдерживать все требования, предъявляемые к соответствующим жидким ЛФП. Имплантаты в виде твёрдых ЛФ должны проходить испытание по показателю «Растворение».
К инфузионным растворам в зависимости от их назначения предъявляются такие дополнительные требования как изоионичность, изогидричность, изотоничность и изовязкость. Для них необходимо проведение испытания «Осмолярность» либо указывать значение теоретической осмолярности. В зависимости от назначения и состава к инфузионным растворам также предъявляются некоторые другие дополнительные требования, которые определяются спецификой использованные субстанции. Например, для плазмозамещающих растворов гидроксиэтилкрахмала и других полимеров рекомендуется определять показатель «Характеристическая вязкость», который описывает структурные свойства полимеров и позволяет оценить степень воздействия на вязкость плазмы крови.
Таким образом, предложенная классификация позволяет дополнить существующие подходы к стандартизации лекарственных форм для парентерального применения. Дальнейшая работа позволит систематизировать введение показателей качества в нормативную документацию на данную группу препаратов.
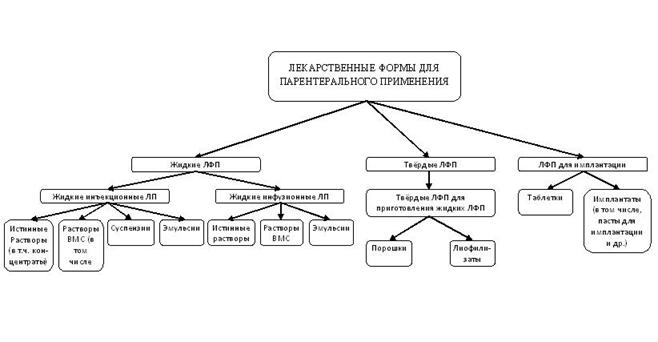
Рисунок 1. Классификация лекарственных форм для парентерального применения
Список литературы:
- Государственная фармакопея Российской Федерации. XII издания. // М.: «Издательство «Научный центр экспертизы средств медицинского применения», 2008. — 704 с.
- Государственная Фармакопея СССР — издание XI. Выпуск 2: Общие методы анализа. Лекарственное растительное сырье. // М: Медицина, 1989. — 398 с.
- Государственный реестр лекарственных средств Российской Федерации. [Электронный ресурс]. // http://grls.rosminzdrav.ru/.
- Отраслевой стандарт «91500.05.001.00 — Стандарты качества лекарственных средств. Основные положения». // Утверждён Приказом Министерства здравоохранения России от 01.11.2001 N 388 «О государственных стандартах качества лекарственных средств».
- Фармацевтическая технология: Технология лекарственных форм / [И.И. Краснюк, С.А. Валевко, Г.В. Михайлова и др.]; под ред. И.И. Краснюка, Г.В. Михайловой. — 2-е изд., стер. // М.: Издательский центр «Академия», 2006. — 592 с.
- European Pharmacopoeia 7th edition. [Электронный ресурс]. // EDQM (European Directorate for the Quality of Medicines and Healthcare). http://online.edqm.eu/entry.htm.
- The International Pharmacopoeia 4th edition. [Электронный ресурс]. // World Health Organization. http://apps.who.int/phint/en/p/about/
- The Japanese Pharmacopeia 16th edition. 2011 [Электронный ресурс]. // Pharmaceuticals and medical devices agency. pp. 67-69.
- United States Pharmacopeia 34th edition. [Электронный ресурс]. // United States Pharmacopeial Convention. http://www.uspnf.com/uspnf/login.
дипломов

Оставить комментарий