Статья опубликована в рамках: XXXI Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 31 марта 2014 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ТРИГИДРАТА АЦЕТАТА НАТРИЯ
Надиров Ермурат Галымбекович
канд. хим. наук, доцент Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Мустафаева Назира Маматкуловна
старший преподаватель Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
Иманбекова Тохтабуби Джумадиловна
канд. техн. наук, доцент Алматинского Университета Энергетики и Связи, Республика Казахстан, г. Алматы
E-mail:
THE THERMAL STABILITY OF SODIUM ACETATE
Nadirov Ermurat
candidate of chemical sciences associate professor of Almaty University of Power Engineering and Telecommunications, Republic of Kazakhstan Almaty
Mustafaeva Nazira
senior Lecturer of Almaty University of Power Engineering and Telecommunications, Republic of Kazakhstan Almaty
Imanbekova Toktabuby
candidate of engineering sciences associate professor of Almaty University of Power Engineering and Telecommunications, Republic of Kazakhstan Almaty
АННОТАЦИЯ
Изучена термическая устойчивость тригидрата ацетата натрия термическим, термогравиметрическим, рентгенографическим и кристаллооптическим методами анализа. Приведены экспериментальные данные, позволяющие утверждать, что ацетату натрия при нагреве присуще преимущественно метанное разложение.
ABSTRACT
The thermal stability of sodium acetate has been investigated using trihydrate thermal, thermogravimetric, and X-ray crystal-analysis methods. There was adduced an experimental evidence proving that the sodium acetate under heating undergoes methane decomposition.
Ключевые слова: термическая устойчивость; тригидрат ацетата натрия; термический, термогравиметрический, рентгенографический и кристаллооптическим методы анализа.
Keywords: thermal stability; sodium acetate trihydrate; thermal, thermogravimetric, X-ray and crystal-analysis methods.
Термическая устойчивость тригидрата ацетата натрия изучалась многими авторами [1—7]. Изучение более определённых данных по термическому разложению ацетата натрия и знаний о свойствах продуктов реакций привели нас к детальному исследованию тригидрата ацетата натрия. Проведя опыты, авторы пришли к выводу, что при нагревании ацетата натрия образуется сода, сажа, вода и метан.
Исходное соединение исследовали термографическим, термограветрическим, ренгенофазовым, кристаллооптическим и физико-химическим методами анализа, методика которых описана в работе [2] . Под микроскопом трёхводный ацетат натрия представлен бесцветными прозрачными обломками зёрен неопределённых форм, цвета интерференции высокие зональные. Кристаллы оптически двуосные положительные, угол 2υ=80º. Коэффициенты светопреломления: Nρ=1.417, Nm = 1.455, Nq = 1,481. Межплоскостные расстояния приведены в таблице 1.
Таблица 1.
Межплоскостные расстояния тригидрата ацетата натрия
|
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
|
60 |
7,68 |
50 |
3,04 |
10 |
2,23 |
10 |
1,804 |
|
20 |
7,25 |
35 |
3,00 |
30 |
2,19 |
75 |
1,788 |
|
80 |
5,44 |
35 |
2,86 |
10 |
2,14 |
40 |
1,776 |
|
50 |
5,22 |
15 |
2,80 |
15 |
2,11 |
5 |
1,741 |
|
20 |
4,78 |
40 |
2,73 |
15 |
2,05 |
5 |
1,707 |
|
60 |
4,63 |
30 |
2,70 |
15 |
2,03 |
10 |
1,576 |
|
80 |
3,94 |
20 |
2,65 |
20 |
1,983 |
30 |
1,513 |
|
20 |
3,84 |
30 |
2,51 |
10 |
1,910 |
10 |
1,501 |
|
30 |
3,69 |
20 |
2,38 |
80 |
1,881 |
30 |
1,468 |
|
100 |
3,56 |
10 |
2,33 |
10 |
1,838 |
|
|
На термограмме тригидрата ацетата натрия присутствуют несколько эндотермических и экзотермических эффектов (рисунок 1). Для того, чтобы выяснить природу этих эффектов, были проведены прокалки исходного препарата при различных температурах и выдержках. В пробах прокалённых при температуре 50º в течении одного часа обнаружены две фазы. Одна из них по своим кристалло-оптическим константам полностью соответствует тригидрату ацетата натрия. Вторая представлена агрегатами из дисперсных зёрен с интенсивной матовой поверхностью. Цвета интерференции до жёлтых. Увеличение выдержки до пяти часов приводит к полному исчезновению в пробах тригидрата ацетата натрия. Содержание второй фазы достигает 100 %. Она представлена игольчатыми кристаллами и удлинёнными пластинками, собранными в волокнистые сноповидные агрегаты. Цвета интерференции серые. Погасание в одних случаях с отрицательным удлинением, в других случаях — косое под углом 40º. Это обстоятельство позволяет отнести кристаллы к моноклинной сингонии. Полученная коноскопическая фигура соответствует двухосной положительной индикатриссе, угол 2υ мал.
Потеря веса проб выдержанных при 50º в течении пяти часов, составляет 40—45 %, что соответствует трём молям воды в тригидрате ацетата натрия. таким образом эндоэффект при 45º на термограмме соответствует полному обезвоживанию исходного продукта (инконгруэнтное плавление). Следующий очень глубокий эндоэффект при 120º связан с кипением выделившийся воды. Сказанное подтверждается тем, что на термограмме исходного продукта, выдержанного при 50º пять часов, эндоэффект при120º отсутствует.
При дифрактограммах исследованных проб отмечено присутствие интенсивных отражений, не принадлежащих трёхводному ацетату натрия (таблица 2). В частности, в пробах с одночасовой выдержкой появляется линия 9,94, а в пробах с пятичасовой выдержкой — линия 9,83. Уменьшение межплоскостного расстояния, по-видимому, связано с увеличением плотности элементарной ячейки безводного ацетата. Удельный вес безводного ацетата натрия, измеренный пикнометрическим методом, оказался равным 1,587 г/см3.
Пробы выдержанные при 120º и 300º в течении трёх часов, состоят из безводного ацетата натрия. Кристаллы имеют призматическую форму. Ширина их достигает 5 микрон, длина 150 микрон. Часты полисинтетические двойники и сноповидные агрегаты. Попадаются также зёрна с неопределёнными отражениями. Коэффициенты светопреломления: Nq=1,486. Nρ=1.410.
При температуре 325º С безводный ацетат натрия плавится — на термограмме появляется эндотермический эффект. Расплавленная и тут же охлаждённая проба имеет белый цвет. Под микроскопом в ней обнаружены пластинчатые кристаллы в виде параллелограммов, с трещинками спайности в двух направлениях. Размеры кристаллов достигают одного миллиметра. По своим оптическим константам они полностью соответствуют безводному ацетату натрия. На воздухе он быстро переходит в водную форму- каждый кристалл окружён каёмкой тригидрата.
T аблица 2.
Межплоскостные расстояния тригидрата ацетата натрия, прокалённого при различных температурах и различных выдержках
|
t=50ºC , τ=1 час |
t=50ºC , τ=1 час |
t=50ºC , τ=1 час |
t t=50ºC , τ=1 час |
t=50ºC , τ=1 час |
|||||
|
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
100 |
9,94 |
100 |
9,83 |
100 |
9,85 |
100 |
9,88 |
100 |
9,85 |
|
10 |
7,65 |
10 |
7,65 |
3 |
7,66 |
— |
— |
— |
— |
|
3 |
5,38 |
10 |
5,37 |
— |
— |
— |
— |
— |
— |
|
8 |
5,21 |
15 |
5,18 |
5 |
5,19 |
— |
— |
— |
— |
|
10 |
5,00 |
15 |
4,95 |
7 |
4,96 |
5 |
4,95 |
20 |
4,95 |
|
5 |
4,78 |
— |
— |
— |
— |
— |
— |
— |
— |
|
10 |
4,64 |
30 |
4,63 |
8 |
4,62 |
5 |
4,61 |
10 |
4,62 |
|
15 |
3,91 |
45 |
3,91 |
13 |
3,92 |
3 |
3,93 |
10 |
3,92 |
|
10 |
3,67 |
20 |
3,70 |
7 |
3,70 |
1 |
3,70 |
— |
— |
|
10 |
3,53 |
30 |
3,53 |
10 |
3,53 |
2 |
3,53 |
— |
— |
|
20 |
3,34 |
15 |
3,35 |
10 |
3,37 |
— |
— |
— |
— |
|
— |
— |
55 |
3,30 |
21 |
3,31 |
8 |
3,29 |
25 |
3,30 |
|
30 |
2,99 |
75 |
2,99 |
23 |
2,99 |
5 |
3,00 |
15 |
2,99 |
|
15 |
2,96 |
50 |
2,96 |
20 |
2,96 |
— |
— |
— |
— |
|
7 |
2,86 |
40 |
2,86 |
15 |
2,86 |
7 |
2,88 |
5 |
2,86 |
|
10 |
2,74 |
35 |
2,74 |
14 |
2,73 |
6 |
2,73 |
— |
— |
|
8 |
2,69 |
30 |
2,69 |
11 |
2,70 |
— |
— |
— |
— |
|
10 |
2,65 |
40 |
2,65 |
8 |
2,65 |
2 |
2,67 |
10 |
2,65 |
|
25 |
2,49 |
45 |
2,49 |
27 |
2,49 |
9 |
2,48 |
35 |
2,48 |
|
27 |
2,44 |
45 |
2,44 |
12 |
2,44 |
3 |
2,45 |
15 |
2,45 |
|
8 |
2,41 |
25 |
2,41 |
7 |
2,41 |
2 |
2,41 |
8 |
2,41 |
|
8 |
2,39 |
20 |
2,38 |
5 |
2,38 |
— |
— |
— |
— |
|
4 |
2,39 |
— |
— |
— |
— |
1 |
2,34 |
2 |
2,33 |
|
10 |
2,23 |
25 |
2,23 |
7 |
2,23 |
3 |
2,24 |
10 |
2,24 |
|
30 |
2,22 |
20 |
2,20 |
5 |
2,19 |
2 |
2,19 |
— |
— |
|
6 |
2,11 |
20 |
2,11 |
8 |
2,12 |
— |
— |
3 |
2,11 |
|
5 |
2,03 |
20 |
2,05 |
6 |
2,06 |
2 |
2,06 |
— |
— |
|
— |
— |
30 |
2,02 |
7 |
2,03 |
3 |
2,03 |
6 |
2,02 |
|
2 |
1,864 |
20 |
1,862 |
— |
— |
— |
— |
2 |
1,871 |
|
10 |
1,776 |
25 |
1,772 |
7 |
1,770 |
— |
— |
1 |
1,770 |
|
2 |
1,720 |
15 |
1,720 |
4 |
1,721 |
2 |
1,729 |
6 |
1,721 |
|
8 |
1,629 |
15 |
1,631 |
7 |
1,632 |
2 |
1,635 |
2 |
1,633 |
|
3 |
1,580 |
15 |
1,575 |
3 |
1,573 |
1 |
1,574 |
6 |
1,676 |
Дифрактограммы всех описанных проб идентичны. При температурах 120º—300ºС всё ещё обнаруживаются линии водного ацетата, после плавления они полностью исчезают.

Рисунок 1. Термограмма тригидрата ацетата натрия
Слабый эндотермический эффект при температуре 250º С (рисунок 1) не объяснён, так как он не сопровождается заметными химическими и физическими изменениями ацетата натрия.
После плавления ацетат натрия стабилен до температуры 400ºС, а потом начинает быстро разлагаться. В пробах обнаруживается карбонат натрия и углистое вещество (цвет проб тёмный). Карбонат натрия представлен отдельными зёрнами с неопределёнными очертаниями и полисинтетическими двойниками. Цвета интерференции высокие зональные. Коэффициенты светопреломления: Nρ=1,415, Nm=1,535, Nq = 1,546. Углистое вещество адсорбировано на поверхности зёрен карбоната натрия и окрашивает их в тёмный цвет. На диффрактограммах проб отмечаются только линии карбоната натрия, углистое вещество рентгеноаморфно (таблица3). Выше температуры 700º углистое вещество выгорает, и проба целиком состоит из карбоната натрия.
Отмеченный на термограммах сильный экзотермический эффект при температурах 450-500ºС, видимо, связан с горением газообразного продукта, получившегося при разложении ацетата натрия. Выгорание углистого вещества происходит постепенно, поэтому это процесс на термограммах не отмечается.
T аблица 3.
Сравнительные данные межплоскостных расстояний пробы, прокалённой выше 400ºС, и карбоната натрия
|
Проба |
Na 2CO3 |7| |
Проба |
Na2CO3 |7| |
||||
|
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
J/J0, % |
d/n, Aº |
|
25 |
3,40 |
8 |
3,43 |
55 |
1,944 |
40 |
1,45 |
|
35 |
3,22 |
12 |
3,22 |
15 |
1,423 |
— |
— |
|
85 |
2,96 |
80 |
1,96 |
60 |
1,878 |
40 |
1,88 |
|
35 |
2,8 |
2 |
2,85 |
45 |
1,704 |
25 |
1,71 |
|
30 |
2,7 |
20 |
2,70 |
30 |
1,674 |
12 |
1,67 |
|
60 |
2,61 |
60 |
2,60 |
10 |
1,650 |
— |
— |
|
75 |
2,59 |
— |
— |
15 |
1,628 |
12 |
1,62 |
|
80 |
2,54 |
60 |
2,54 |
15 |
1,607 |
— |
— |
|
100 |
2,36 |
100 |
2,36 |
15 |
1,572 |
25 |
1,57 |
|
15 |
2,33 |
— |
— |
15 |
1,559 |
— |
— |
|
50 |
2,25 |
40 |
2,25 |
15 |
1,522 |
8 |
1,52 |
|
60 |
2,19 |
60 |
2,18 |
15 |
1,492 |
— |
— |
|
75 |
2,17 |
— |
— |
20 |
1,477 |
16 |
1,482 |
|
15 |
2,12 |
4 |
2,11 |
10 |
1,452 |
6 |
1,451 |
|
30 |
2,03 |
14 |
2,02 |
10 |
1,383 |
8 |
1,388 |
Термогравитограмма тригидрата ацетата натрия имеет ступенчатый вид (рисунок 2). Наклонная ветвь при 20—100º соответствует обезвоживанию пробы (потеря веса 40 %), затем следует горизонтальный участок при 100-400º, соответствующий существованию безводной соли. После перегиба при 400-500º, сопровождаемого потерей 13 % веса, кривая вновь становится почти горизонтальной. Потеря веса в 13 % соответствует одной молекуле воды и одной молекуле метана. В пробе остаётся только сода и углистое вещество — сажа. Сажа горит при температурах 700—900 ºС. На термогравитограмме опять, появляется перегиб, (потеря 9 % веса). Полная потеря веса трёхводного ацетата натрия при нагревании составляет 63 %.
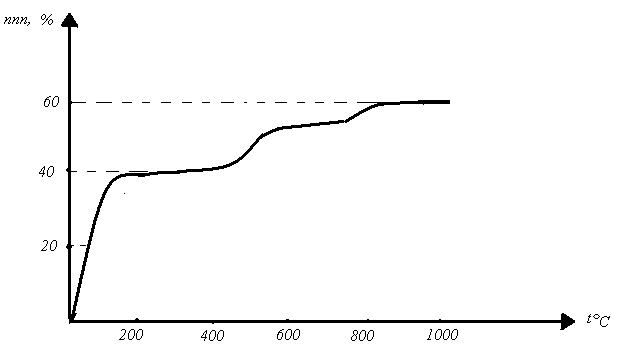
Рисунок 2. Термогравитограмма тригидрата ацетата натрия
Таким образом, в соответствии с вышеизложенным химизм разложения тригидрата ацетата натрия при нагревании можно представить следующим образом:

Для наглядности разложение безводной соли можно представить в виде схемы, представленной на рисунке 3.
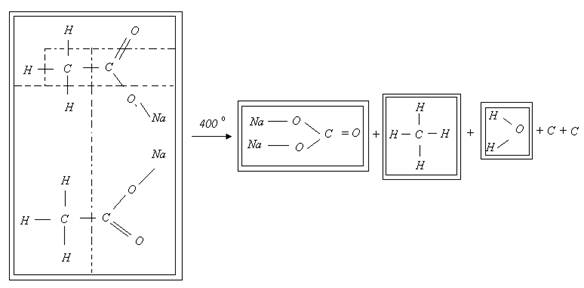
Рисунок 3. Схема разложения безводной соли ацетата натрия
Для подтверждения указанной схемы провели следующий опыт.
Десять грамм безводного ацетата натрия загрузили в автоклав и выдержали его в муфельной печке в течении одного часа при температуре 700 ºС. Затем автоклав охлаждали до комнатной температуры и открыли. В автоклаве оказалось вещество чёрного цвета весом 7,826 г и бесцветная прозрачная негорючая жидкость без запаха с вяжущим вкусом (вес 1,195 г). Испытание лакмусовой бумажкой показало, что жидкость имеет щелочную реакцию (раствор соли в воде).
Таким образом, следует считать доказанным, что при нагревании ацетата натрия образуется сода, сажа, вода и метан. В литературе имеются сведения, что ацетат натрия при нагревании разлагается на соду и ацетон [2, 5].
Имеется мнение, что при температурах выше 600º начинается обугливание и наряду с кетонным разложением частично возможно и метанное. Автор полагает, что образование метана обусловлено разложением ацетона.
Для определения термодинамической возможности протекания различных реакций разложения ацетата натрия мы рассчитали изменение свободной энергии Δ F для следующих реакций:
а. кетонное разложение ацетата натрия
2CH3COONaтв= Na2СО3тв+ СН3СОСН3Г
(Δ F=10,7ккал/моль)
б. метанное разложение ацетата натрия
2CH3COONaтв = Na2Отв + СН4Г +СО2Г+Н2ОГ +2Ств
(Δ F=12,8ккал/моль)
в. стадийное метанное разложение
1) 2CH3COONaТВ + Н2Ож = СН4Г + NaНСО3тв
2) 2 NaНСО3тв = Na2СО3тв + СО2Г + Н2ОГ
(Δ F=17,7ккал/моль)
г. метанное разложение по нашей схеме
2 NaНСО3тв = Na2СО3тв + 2Ств + СН4Г + Н2ОГ
(Δ F=7,3/моль)
Расчёты проводили по методу Тёмкина-Шварцмана. Наиболее вероятные реакции (а) и (г), однако меньшее значение величины изменения свободной энергии Δ F в реакции (г) и процесс обугливания при более низких температурах (ниже 500º) , говорит в пользу реакции (г).
Проведённые нами исследования не подтвердили схему разложения ацетата натрия на соду и ацетон.
Список литературы:
1.Ахметов С.Ф., Ахметова Г.Л., Надиров Е.Г., Бакеев И.Ж. неорганической химии,17, 1, 48, 1972.
2.Ипатьев В.Н., Шульман Г. ЖРФХО,36,764,1904.
3.Постников В.А., Соболь О.В., Соболев А.Ю., Горбань С.В. Кинетика и термодинамика плавления и кристаллизации в системе ацетат натрия тригидрат–сульфат натрия декагидрат // Тезисы докладов. VI Международная научная конференция кинетика и механизм кристаллизации. Самоорганизация при фазообразовании. Иваново 2010. — С. 32.
4.Рубинштейн А.М., Якерсон В.И. Ж. общей химии,30,9,2789,1960.
5.Тёмкин М.И., Шварцман Л.А. Успехи химии,17,259,1948.
6.Херд Г.Д. Пиролиз соединений углерода, ИЛ,1938
7.Reed R.I. J. Chem.Phys., 21,377, 1953
дипломов


Оставить комментарий