Статья опубликована в рамках: XXV Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 07 октября 2013 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МЕТОД ПРОВЕРКИ НА ЦИТОТОКСИЧНОСТЬ ПОЛИМЕРНЫХ МАТЕРИАЛОВ МЕДИЦИНСКОГО НАЗНАЧЕНИЯ IN VITRO
Горбунова Евгения Михайловна
магистрант Московского государственного университета тонких химических технологий им. М.В. Ломоносова, г. Москва
E-mail: margo.rock@mail.ru
Шульгина Елена Николаевна
магистрант Московского государственного университета тонких химических технологий им. М.В. Ломоносова, г. Москва
Люсова Людмила Ромуальдовна
проф., д-р техн. наук, зав. кафедрой химии и технологии переработки эластомеров Московского государственного университета тонких химических технологий им. М.В. Ломоносова, г. Москва
Колмычкова Кира Ивановна
науч. сотр., Государственное научное учреждение центр экспериментальной эмбриологии и репродуктивной биотехнологии Россельхозакадемии, г. Москва
E-mail: kirruccha@rambler.ru
Косовский Глеб Юрьевич
канд. мед. наук Государственное научное учреждение центр экспериментальной эмбриологии и репродуктивной биотехнологии Россельхозакадемии, г. Москва
E-mail: info@ceerb.ru
Косовская Елена Владимировна
ст. науч. сотр., Государственное научное учреждение центр экспериментальной эмбриологии и репродуктивной биотехнологии Россельхозакадемии, г. Москва
E-mail:
METHOD OF TESTING THE CYTOTOXICITY OF POLYMERIC MATERIALS FOR MEDICAL USE IN VITRO
Evgenia Gorbunova
undergraduate Moscow State University of Fine Chemical Technology named after M.V. Lomonosov, Moscow
Elena Shulgina
undergraduate Moscow State University of Fine Chemical Technology named after M.V. Lomonosov, Moscow
Ludmila Lusova
prof., Dr. Sc. sciences and head. Department of Chemistry and Processing of Elastomers Moscow State University of Fine Chemical Technology named after M.V. Lomonosov, Moscow
Kira Kolmichkova
scientific. et al Center of embryology and reproductive biotechnology of the Russian of agricultural sciences, Moscow
Gleb Kosovskiy
candidate. honey. Science Center of embryology and reproductive biotechnology of the Russian of agricultural sciences, Moscow
Elena Kosovskia
art. Scientific. et al.,Center of embryology and reproductive biotechnology of the Russian of agricultural sciences, Moscow
АННОТАЦИЯ
Статья включает в себя результаты экспериментов по определению цитотоксичности эластомерных материалов, создаваемых для использования в медицине. Был проведён сравнительный анализ данных, полученных на культуральных чашках Петри и с помощью системы для клеточного анализа RTCA iCELLigence. Сделан вывод о возможности изготовления изделий на основе исследуемых образцов.
ABSTRACT
The article contains the results of experiments to determine the cytotoxicity of elastomeric materials created to be used in medicine. Comparative analysis of the data obtained in the culture Petri dishes using the system for cellular analysis RTCA iCELLigence was carried out. It was concluded that it is possible to manufacture products based on the test samples.
Ключевые слова: цитотоксичность; культуры клеток; урологические катетеры.
Keywords: cytotoxicity, cell culture, urinary catheters.
В настоящее время огромную роль в жизни человека играют эластомерные материалы, применяемые во многих отраслях. На их основе создаются различные изделия, в том числе — используемые в медицине. Примером могут служить урологические катетеры. Эти изделия должны находиться в непосредственном контакте с тканями человека, не изменяя своих свойств и не повреждая сами ткани.
К сожалению, на поверхности урологических катетеров могут образовываться биоплёнки, способствующие развитию катетер-ассоциированных инфекций. Для борьбы с ними, в некоторых случаях, поверхность катетеров обрабатывают специальными антимикробными веществами или выполняют катетер со специальным покрытием. Данные вещества могут оказывать токсическое воздействие не только на бактерии, образующие биоплёнку, но и на ткани человека. Однако катетеры, даже при долгосрочном использовании, должны оставаться биоинертными. Таким образом, при выборе компонентов материала для катетеров очень важным параметром является их цитотоксичность, которую необходимо свести к минимуму. До того как данные медицинские изделия будут допущены к широкому использованию, им необходимо пройти многочисленные испытания на цитотоксичность [2, с. 406—407].
В настоящее время, наиболее эффективным материалом для изготовления медицинских катетеров считается силикон.
В рамках написания дипломной магистерской работы были испытаны, с учётом методики исследования цитотоксичности медицинских изделий in vitro (ГОСТ Р ИСО 10993-5-2009 [1, с. 1—15]), следующие оригинальные образцы:
образец 1 — силикон с добавлением антибиотика;
образец 2 — силикон с добавлением антимикробного вещества в виде порошка;
образец 5 — силикон с добавлением антимикробного вещества в виде раствора.
Для определения токсического воздействия образцов на клетки были использованы субкультивированные после размораживания культуры: фетальные фибробласты крупного рогатого скота (ФФ КРС) и мезенхимные стволовые клетки костного мозга крыс (МСК КМ). Размораживание, культивирование, субкультивирование культур клеток проводилось по стандартным протоколам. Культивирование проводилось на среде DMEM/F12 c добавление глутамина 300 мг, 10 % FBS без добавления антибиотиков и антимикотиков. Перед испытанием все образцы были обработаны УФ в течение 15 минут.
Исследования по оценке цитотоксичности эластомерных материалов были проведены двумя способами: в культуральных чашках Петри и с помощью системы для клеточного анализа в режиме реального времени RTCA iCELLigence производителя ACEA Biosciences.
Опытные образцы были помещены на монослой клеток конфлюэнтностью 75—95 % в чашках Петри. Для контроля были использованы культуры клеток без образцов. После 24 часов культивирования клеток вместе с образцами, были проведены визуальная оценка и фотодокументация с помощью инвертированного микроскопа Nikon. По фотографиям можно визуально оценить влияние материалов на культуры клеток.
На рисунках 1 и 3 представлены фотографии монослоя клеточных культур МСК КМ (рисунок 1) и ФФ КРС (рисунок 3). Далее, для примера, приведены фотографии монослоя (рисунок 2 и рисунок 4) после контакта с образцом 2 в течение 24 часов. Подобные фотографии были получены и для образца 1. Образец 5 проявил цитотоксический эффект в той же мере после 48 часов контакта с культурами клеток. Это говорит о более медленном выходе антимикробного вещества из эластомерного материала в среду. Таким образом, исходя из полученных экспериментальных данных, можно сделать вывод, что образцы 1, 2, 5 в той или иной мере оказывают цитотоксическое воздействие как на культуру клеток ФФ КРС, так и на МСК КМ крыс. Было отмечено, что образец 2 обладает наибольшей токсичностью для исследованных культур клеток.
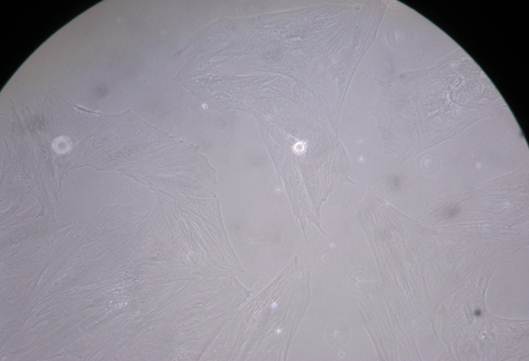
Рисунок 1. МСК, монослой, который не был подвергнут каким-либо воздействиям (контроль)
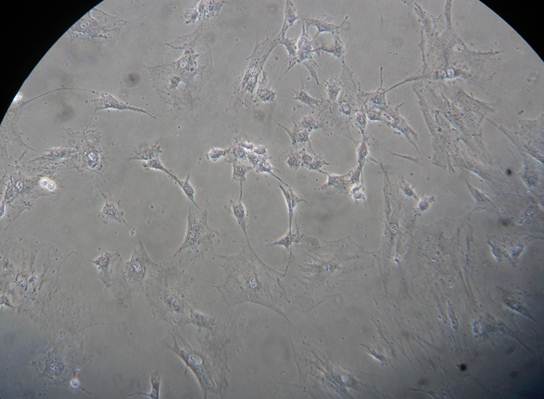
Рисунок 2. МСК, монослой, контактировавший с образцом 2
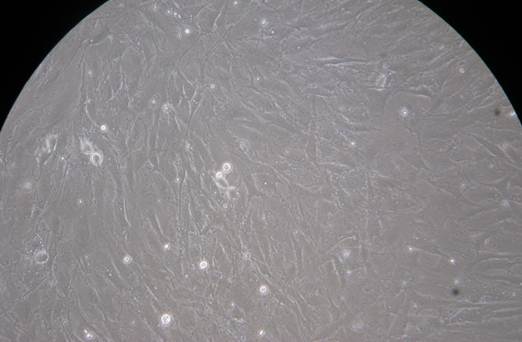
Рисунок 3. ФФ КРС, монослой, который не был подвергнут каким-либо воздействиям (контроль)

Рисунок 4. ФФ КРС, монослой, контактировавший с образцом 2
В дальнейшем были проведены аналогичные эксперименты на системе для клеточного анализа в режиме реального времени RTCA iCELLigence производителя ACEA Biosciences. Для исследования был выбран протокол Proliferation/Cytotoxicity, таблица 1.
Таблица 1.
Протокол исследования Proliferation/Cytotoxicity
|
№ п/п |
Продолжительность операции, мин |
Число экспериментальных точек |
Название операции |
|
1 |
1 |
1 |
Среда |
|
2 |
240 |
240 |
Адгезия |
|
3 |
1200 |
20 |
Пролиферация |
|
4 |
240 |
240 |
Внесение образца |
|
5 |
4020 |
268 |
Пролиферация |
После завершения эксперимента были получены данные, иллюстрирующие поведение культур клеток в ходе опыта. С помощью этих данных была построена зависимость клеточного индекса от времени, представленная на рисунок 5.
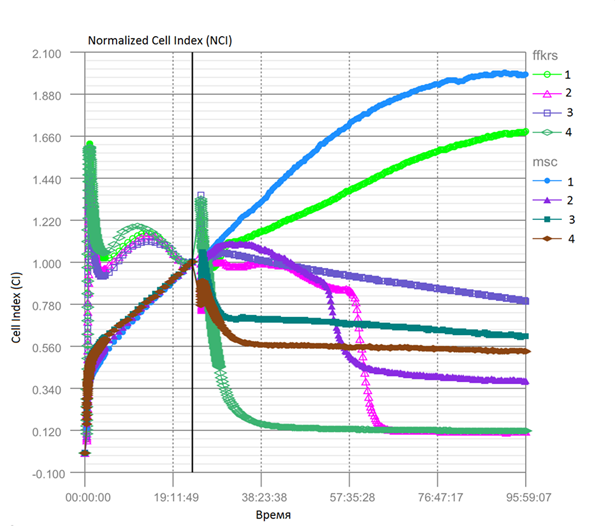
Рисунок 5. Зависимость клеточного индекса культур клеток ФФ КРС и МСК КМ от времени. Кривые: 1 — контроль; 2 — образец 1; 3 — образец 2; 4 — образец 5
Используя нормализованный клеточный индекс, было показано, что культуры клеток МСК КМ и ФФКРС в лунках до токсического воздействия идентичны. Различия в пролиферации наблюдаются только после внесения образцов. Результаты, полученные на приборе, соотносятся с данными из экспериментов на культуральных чашках Петри: все образцы оказывают цитотоксическое воздействие на культуры клеток. Как видно из рисунка 6, образец 5 проявляет цитотоксичность в первые 24 часа после внесения в лунку с культурой, а не через 48, как это было в первом опыте. Предположительно, это связано с меньшим объёмом среды в лунке по отношению к культуральным чашкам Петри. Таким образом, достаточная концентрация антимикробного вещества достигается в более короткие сроки.
Следует отметить, что более выраженное цитотоксическое воздействие материалы оказывают на культуру ФФ КРС, моделирующую соединительную ткань. Полученные данные говорят о том, что опытные образцы не подходят для создания катетеров. Экспериментальные данные свидетельствуют о цитотоксическом влиянии эластомерных образцов, связанном с концентрацией антимикробных веществ. В связи с чем, использование силикона с оптимально подобранной концентрацией антимикробного вещества, представляется перспективным.
Список литературы:
1.ГОСТ Р ИСО 10993-5-2009 Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследования на цитотоксичность: методы in vitro. — Взамен ГОСТ Р ИСО 10995.5-99; Введ. От 2.12.2009 — 16 с.
2.Культура животных клеток: практическое руководство/ Фрешни Р.Я.; пер. с 5-го англ. издания М.: Бином. Лаборатория знаний, 2010 — 691 с.
дипломов


Оставить комментарий