Статья опубликована в рамках: XLI Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 28 января 2015 г.)
Наука: Сельскохозяйственные науки
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ИЗУЧЕНИЕ ПРИЖИВАЕМОСТИ ШТАММА AGROBACTERIUM RADIOBACTER 204 В РИЗОСФЕРЕ ВИНОГРАДНОГО РАСТЕНИЯ
Клименко Нина Николаевна
аспирант, Институт агроэкологии и природопользования НААН Украины, Украина, г. Киев
THE STUDY OF STRAIN AGROBACTERIUM RADIOBACTER 204 SURVIVAL RATE IN THE GRAPE RHIZOSPHERE PLANTS
Klymenko Nina
postgraduate, Institute of Agroecology and Environmental Management of NAAS of Ukraine, Ukraine, Kyiv
АННОТАЦИЯ
Целью работы было изучение способности азотфиксирующего микроорганизма Agrobacterium radiobacter 204 приживаться в ризосфере виноградного растения под воздействием антибиотиков. Для этого были выделены антибиотикоустойчивые штаммы данного микроорганизма, устойчивые к действию стрептомицина, ампициллина и канамицина. Установлено, что антибиотикорезистентные мутанты способны приживаться в ризосфере винограда и их численность постепенно снижалась на протяжении исследования. Таким образом, штамм-основа биопрепарата Диазофит действительно способен приживаться в ризосфере винограда.
ABSTRACT
The aim of this work was to study the ability of nitrogen-fixing microorganism Agrobacterium radiobacter 204 to survive in the grape plants rhizosphere under the influence of antibiotics. For this purpose there were selected antibiotic-resistant strains of this microorganism resistant to streptomycin, ampicillin, and kanamycin. It was established that antibiotic-resistant mutants are able to survive in the rhizosphere of grapes and their quantity gradually decreased throughout the study. Thus, the strain A. radiobacter 204, which biological preparation Diazofit based on, really able to survive in the grapes rhizosphere.
Ключевые слова: Диазофит; Agrobacterium radiobacter 204; антибиотикорезистентные микроорганизмы; ризосфера виноградного растения.
Keywords: Diazofit; Agrobacterium radiobacter 204; antibiotic-resistant microorganisms; grape plant rhizosphere.
Общеизвестно, что микробные препараты, используемые при выращивании различных сельскохозяйственных культур, обладают целым рядом полезных свойств. Во-первых, они являются экологически безопасными для окружающей среды и человека, во-вторых, способны улучшать рост и минеральное питание растений, повышать урожайность и устойчивость к неблагоприятным факторам. Также штаммы-основы бактериальных препаратов способны влиять на микробоценозы почвы и ее физико-химические свойства [2; 8]. Однако эффективность использования микробиологических препаратов зависит от способности штаммов к приживаемости в ризосфере того или иного растения.
Исследования способности микроорганизмов приживаться в ризосфере сельскохозяйственных растений проводились многими учеными. Так, было установлено, что бактерии родов Azospirillum и Pseudomonas способны приживаться в ризосфере озимой ржи [12]. В условиях вегетационных опытов на вермикулите и почвенном субстрате изучена способность штаммов Agrobacterium radiobacter 10 [6] и Bacillus [9] приживаться в ризосфере растений капусты. Выяснено, что исследованные штаммы хорошо приживались на корнях капусты, и их численность постепенно снижалась с нескольких миллионов после инокуляции до нескольких десятков колоний в конце вегетации.
В вегетационном опыте была изучена динамика численности интродуцированных мутантов диазотрофов (Azospirillum brazilense 11 и Enterobacter aerogenes 30) в почве ризосферы ярового ячменя. Выявлено, что эти штаммы способны адаптироваться и активно функционировать на поверхности корней данного растения [11].
В литературных источниках можно встретить информацию о том, что в ризосфере культурных растений успешно приживаются не только бактериальные штаммы, но и микромицеты. Так, установлена способность штамма Chaetomium globosum 3250 приживаться в ризосфере яровой пшеницы в течение вегетационного периода [10]. Через 20 суток исследования количество этих микроорганизмов в верхнем слое почвы достигала 7,5—51·103 колониеобразующих единиц (КОЕ).
Исследования, проведенные рядом автором, подтверждают, что штамм-основа (Enterobacter nimipressuralis 32-3) микробного препарата Фосфоэнтерин способен приживаться в ризосфере зерновых и овощных культур [1; 4; 5].
Однако способность штамма A. radiobacter 204 приживаться в ризосфере виноградного растения исследована недостаточно глубоко. Поэтому целью нашей работы было изучение приживаемости штамма-основы микробного препарата Диазофит в почве ризосферы винограда.
Материалы и методы. Азотфиксирующий штамм A. radiobacter 204 является основой микробного препарата Диазофит. Данный препарат рекомендуется для улучшения азотного питания растений. Кроме азотфиксирующей активности, обладает ростостимулирующими и биопротекторными свойствами. Исследования проводили в условиях вегетационного опыта с виноградом сорта Мускат белый на подвое Шасла х Берландиери 41 Б. Продолжительность опыта составляла 70 суток. Приживаемость A. radiobacter 204 в ризосфере винограда изучали при помощи его стрептомицин-, ампициллин- и канамицинрезистентных мутантов. Антибиотикорезистентные мутанты были получены по методике [6]. Корневую систему саженцев винограда перед высадкой обрабатывали суспензией суточной культуры антибиотикорезистентных бактерий (10,2—11,5 млн. КОЕ/мл): 6 мл на каждый саженец. Растения высаживали в сосуды, заполненные лугово-аллювиальной карбонатной почвой. Основные характеристики почвы: запасы гумуса 1,5—2,2 %; содержание подвижного азота 11—18 мг/кг почвы, фосфора — 32—38 мг/кг, калия — 260—430 мг/кг; реакция почвенного раствора рН 8,2—8,5; содержание карбонатов 15—37 %; содержание активной извести — 10—15 %. Данные почвенные показатели являются оптимальными для выращивания винограда. Повторность опыта шестикратная.
Численность антибиотикорезистентных бактерий в ризосферной почве определяли методом глубинного посева определенных разведений почвенной суспензии на питательную среду (гороховый агар) с добавлением антибиотиков: стрептомицина 1500 ед./мл, ампициллина — 130 ед./мл, канамицина — 140 ед./мл, повторность пятикратная. Образцы почвы для контрольного варианта отбирали в ризосфере растений, корневая система которых не была инокулирована.
Результаты и их обсуждение. Как показали наши исследования, изучаемый штамм был наиболее устойчив к действию стрептомицина: получен мутант, который выдерживает концентрацию 1500 ед./мл. В то же время резистентность мутантов, полученных для ампициллина и канамицина, не превышала 130 и 140 ед./мл соответственно.
Установлено, что численность стрептомицинрезистентных микроорганизмов A. radiobacter 204 в почве ризосфере на 14 сутки опыта составляла 15,20 млн. КОЕ/г сухой почвы (рис. 1). Через 28 и 42 суток их численность несколько снизилась: до 12,78 и 12,07 млн. соответственно. Однако на 56 сутки с момента закладки опыта количество колоний полученного мутанта составляло 10,65 млн./г сухой почвы, а на 70 сутки снизилось до 5,44 млн./г сухой почвы.
На протяжении эксперимента отмечено, что динамика численности бактерий, которые в естественной среде устойчивы к воздействию стрептомицина (контроль), была ниже, чем у мутанта исследуемого штамма. Так, количество бактерий в контроле на протяжении 14—42 суток постепенно снижалось с 9,71 до 9,60 и 8,88 млн. КОЕ/г сухой почвы соответственно. На 56 сутки количество микроорганизмов, резистентных к действию стрептомицина, упало до 6,24 млн., а в конце исследования составляла всего 3,36 млн. КОЕ/г сухой почвы.
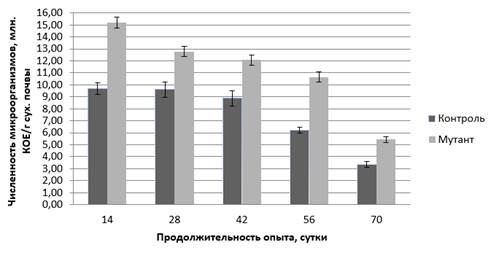
Рисунок 1. Численность стрептомицинрезистентных микроорганизмов штамма A . radiobacter 204 в ризосфере виноградного растения
Похожая тенденция наблюдалась и для ампициллинрезистентных бактерий (рис. 2).
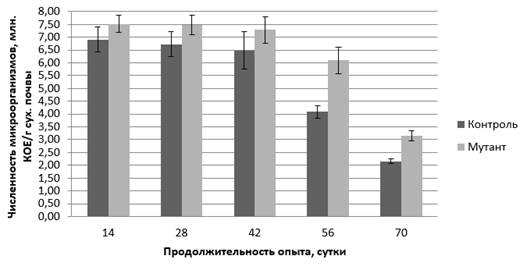
Рисунок 2. Численность ампициллинрезистентных микроорганизмов штамма A . radiobacter 204 в ризосфере виноградного растения
Так, на 14 день исследований их количество в почве ризосферы составляло 7,52, на 28 и 42 сутки — 7,47 и 7,28 млн. КОЕ/г сухой почвы соответственно. На 56 день исследований отмечено снижение их числа до 6,10 млн. КОЕ, а в конце эксперимента (на 70 сутки) — до 3,15 млн. КОЕ/г сухой почвы.
Численность микроорганизмов, обладающих естественной устойчивостью к воздействию ампициллина (контроль), на протяжении опыта постепенно снижалась и составляла на 14, 28, 42 сутки: 6,91, 6,72 и 6,48 млн. КОЕ/г сухой почвы соответственно. На 56 день опыта количество ампициллинрезистентных бактерий достигало 4,08, а на 70 сутки — 2,16 млн. КОЕ/г сухой почвы.
Нами также исследована приживаемость канамицинрезистентного мутанта в ризосфере виноградного растения (рис. 3). Выявлено, что данный микроорганизм имел наибольшую численность в почве по сравнению с бактериями, устойчивыми к действию стрептомицина и ампициллина. Так, на 14 сутки исследования его количество составляло 17,02 млн. КОЕ/г сухой почвы.
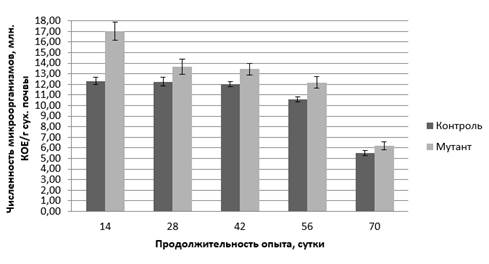
Рисунок 3. Численность канамицинрезистентных микроорганизмов штамма A . radiobacter 204 в ризосфере виноградного растения
На 28 сутки этот показатель составлял 13,64 млн. КОЕ. На протяжении 42, 56 и 70 суток численность канамицинрезистентных мутантов в ризосфере снизилась: до 13,43, 12,19 и 6,20 млн. КОЕ/г сухой почвы соответственно. Итак, для микроорганизмов, устойчивых к канамицину, сохраняется та же тенденция, что и для предыдущих резистентных мутантов, а именно: постепенное снижение их численности в ризосферной почве винограда на протяжении исследования.
Численность бактерий, устойчивых к действию канамицина в контроле, также постепенно снижалась на протяжение всего периода исследования. Так, на 14 и 28 сутки она составляла 12,32 и 12,24 КОЕ/г сухой почвы соответственно. На 42 сутки количество канамицинрезистентных микроорганизмов снизилось до 12,00, через две недели (на 56 сутки) — до 10,56, а на 70 сутки исследования — до 5,52 млн. КОЕ/г сухой почвы.
Итак, исследование динамики численности антибиотикорезистентных мутантов штамма A. radiobacter 204 в почве показало, что они способны приживаться в ризосфере виноградного растения. Эти результаты объясняют данные, полученные нами в полевом опыте, а именно: использование Диазофита оказывает положительное влияние на рост, развитие и урожайность винограда [3].
Таким образом, наши результаты свидетельствуют о том, что штамм A. radiobacter 204 действительно способен приживаться в ризосфере винограда. Установлено, что наибольшая численность бактерий в ризосферной почве отмечена для канамицинрезистентных бактерий.
Список литературы:
1.Баранская М.И. Способность штамма Enterobacter nimipressuralis 32-3 приживаться в ризосфере яровых зерновых / М.И. Баранская // Сельскохозяйственная микробиология: Межведомственный тематический научный сборник. Чернигов, — 2008. — Вып. 7. — с. 101—108 (укр.).
2.Завалин А.А. Применение биопрепаратов и биологический азот в земледелии Нечерноземья / А.А. Завалин, Н.С. Алметов. М.: Издательство ВНИИА, 2009. — 152 с.
3.Клименко Н.Н. Новое в технологии выращивания привитого винограда / Н.Н. Клименко, О.Е. Клименко, Н.И. Клименко, А.Р. Акчурин, Л.А. Чайковская // Виноградарство и виноделие: межвед. темат. научн. сборник. Одесса: ННЦ «ИвиВ им. В.Е. Таирова», — 2013. — Вып. 50. — с. 107—111 (укр.).
4.Ключенко В.В. Размножение бактерий Enterobacter nimipressuralis 32-3 в ризосфере озимой пшеницы / В.В. Ключенко, М.И. Баранская, Л.А. Чайковская // Сельскохозяйственная микробиология. — 2010. — Вып. 12. — с. 87—92 (укр.).
5.Мельничук Т.Н., Пархоменко Т.Ю., Татарин Л.Н. Интродукция фосфатмобилизивного штамма Enterobacter nimipressuralis 32-3 в ризосферу капусты белоголовой / Т.Н. Мельничук, Т.Ю. Пархоменко, Л.Н. Татарин // Фосфор и калий в земледелии. Проблемы микробиологической мобилизации. Чернигов-Харьков, 2004. — с. 81—85 (укр.).
6.Мельничук Т.Н. Некоторые аспекты эффективного использования биопрепаратов при выращивании овощных культур / Т.Н. Мельничук, В.Ф. Патика, Н.Г. Осенний // Нетрадиционное растениеводство, экология и здоровье: мат-лы 7 Междунар. научно-практ. конф. Симферополь, 1998. — с. 441—442.
7.Методы общей бактериологии / под ред. Ф. Герхардта и др.; пер. с англ.: в 3 т. М.: Мир, — 1983. — Т. 2. — 1984. — С. 29—31.
8.Микробные препараты в земледелии. Теория и практика / Под ред. В.В. Волкогона. К.: Аграрная наука, 2006. — 312 с. (укр.)
9.Пархоменко Т.Ю. Интродукция штаммов рода Bacillus в ризосферу капусты // Научные записки Тернопольского национального педагогического университета им. Владимира Гнатюка. Серия: Биология, — 2007. — № 2 (32). — с. 101—103 (укр.).
10.Патыка В.Ф. Способность Chaetomium globosum Kunze ex FR. приживаться в ризосфере яровой пшеницы и колонизировать ее корневую систему / В.Ф. Патика, Е.П. Копылов, С.П. Надкерничный // Микробиологический журнал, — 2007. — № 4, том 69. — с. 54—62 (укр.).
11.Патыка В.Ф. Интродукция азотфиксирующих бактерий в корневой зоне ярового ячменя / В.Ф. Патыка, Е.П. Копылов // Агроэкологический журнал, — 2002. — № 3. — с. 26—29 (укр.).
12.Maltseva N.N., Nadkernichnaya E.V., Kanivets N.A. Associations of nitrogen-fixing bacteria with winter rue // Proceedings of the 10th International Congress of Nitrogen Fixation “Nitrogen Fixation: Fundamental and Applications”, St. Petersburg, Russia, 1995. Kluwer Academic Publisher. Current Plant Science and Biotechnology in Agriculture. — Vol. 27, — 1995. — p. 769.
дипломов


Оставить комментарий