Статья опубликована в рамках: XI Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 15 августа 2012 г.)
Наука: Биология
Скачать книгу(-и): Сборник статей конференции, Сборник статей конференции часть II
- Условия публикаций
- Все статьи конференции
дипломов
ИММУННЫЙ ОТВЕТ ПРОТИВ НАТИВНЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ ВЫЗЫВАЕТ АТЕРОСКЛЕРОЗ У КРЫС
Фомина Ксения Владимировна
инженер кафедры иммунологии и клеточной биологии, ФГБОУ ВПО «УдГУ», г. Ижевск
E-mail:
Бедулева Любовь Викторовна
доцент, д-р биол. наук, профессор кафедры иммунологии и клеточной биологии ФГБОУ ВПО «УдГУ», г. Ижевск
E-mail: blv76@mail.ru
Мальцева Ольга Николаевна
студент, ФГБОУ ВПО «УдГУ», г. Ижевск
Меньшиков Игорь Викторович
профессор, д-р биол. наук, заведующий кафедрой иммунологии и клеточной биологии ФГБОУ ВПО «УдГУ», г. Ижевск
E-mail: MIV140560@yandex.ru
IMMUNERESPONSEAGAINST NATIVE LOW-DENSITY LIPOPROTEIN CAUSES ATHEROSCLEROSIS IN RATS
Kseniya Fomina
Engineer Department of Immunology and Cell Biology, Udmurt State University, Izhevsk
Liubov Beduleva
PhD, professor of Department of Immunology and Cell Biology, Udmurt State University, Izhevsk
Olga Maltseva
student of Udmurt State University, Izhevsk
Igor Menshikov
PhD, hеad of Department of Immunology and Cell Biology, Udmurt State University, Izhevsk
АННОТАЦИЯ
Целью работы была проверка гипотезы, что основной причиной атеросклероза является развитие аутоиммунной реакции к нативным, а не к окисленным ЛПНП. Для этого крыс иммунизировали нативными ЛПНП человека. Обнаружено, что иммунизация крыс нативными ЛПНП человека вызывает развитие дислипопротеинемии, увеличение объема периваскулярной и эпикардиальной жировой ткани и атеросклеротические повреждения стенки аорты, что свидетельствует о том, что иммунный ответ против нативных липопротеинов низкой плотности является причиной развития атеросклероза.
ABSTRACT
The aim of the work was to test the hypothesis that the main cause of atherosclerosis is the development of an autoimmune reaction to native, but not to oxidized LDL. Rats were immunized with native human LDL. Immunization of rats with native LDL causes dyslipoproteinemia, increasing perivascular and epicardial adipose tissue and atherosclerotic lesions of the aortic wall. The results suggest that the immune response against native LDL causes atherosclerosis.
Ключевые слова: нативные липопротеины низкой плотности; атеросклероз; дислипидемия; эпикардиальный жир.
Keywords: native low-density lipoproteins; atherosclerosis; dyslipidemia; epicardial adipose tissue.
Этиология и патогенез атеросклероза остаются неизвестны. Большинство современных гипотез о патогенезе атеросклероза основываются на ключевом факте связи между нарушением обмена липопротеинов и формированием атеросклеротических бляшек. Однако почему и как происходит нарушение обмена липопротеинов, ведущее к развитию заболевания остается главным невыясненным вопросом атерогенеза. В литературе обсуждается много внешних и внутренних факторов, ведущих к нарушению обмена липопротеинов. Наиболее популярна сегодня гипотеза об аутоиммунной природе атеросклероза, согласно которой причиной нарушения обмена липопротеинов является развитие аутоиммунной реакции против модифицированных (окисленных) липопротеинов низкой плотности (оЛПНП) [5, 7]. Однако данные об уровне аутоантител к оЛПНП у больных атеросклерозом и здоровых людей противоречивы [4, 6]. В то же время известны факты существования в норме аутоантител к нативным ЛПНП (нЛПНП), уровень которых у больных атеросклерозом людей выше, чем у здоровых [1, 2]. На основании этих и других фактов нами была сформулирована гипотеза о том, что основной причиной дислипопротеинемии и атерогенеза является развитие аутоиммунной реакции к нативным, а не к окисленным ЛПНП. Одним из способов проверки гипотезы, направленной на определение этиологического фактора развития того или иного заболевания, является возможность вызвать этим фактором развитие заболевания у экспериментальных животных. Поэтому с целью проверки гипотезы мы попытались индуцировать атеросклероз у крыс путем иммунизации их нативными гетерологичными липопротеинами низкой плотности.
Материал и методика исследований
Крысы Wistar были иммунизированы нативными ЛПНП человека, полученными из свежей плазмы (Sigma) в составе неполного адъюванта Фрейнда (НАФ) (Sigma) однократно, внутрикожно в дозе 200 мкг. Ампула, содержащая ЛПНП, вскрывалась в день иммунизации. Контрольным животным вводили НАФ. Крысы содержались на стандартном рационе. Кровь забирали еженедельно в течение 13 недель кардиальной пункцией. Последний забор крови был выполнен через 20 недель после иммунизации. В сыворотке крови определяли уровень антител к ЛПНП человека, уровень общего холестерина, холестерина ЛПНП, холестерина ЛПВП. Антитела против ЛПНП определяли по методу, описанному Хлюстовым B.Н., 1999 [2]. Для анализа были использованы ЛПНП из ампулы, вскрытой в день анализа. Общий холестерин определяли ферментативным методом с помощью набора Холестерин ФС («Диакон-ДС»). Данные представляли как разницу (Δ) средних значений между группой опытных и контрольных животных. Для определения значимости различий был использован критерий Манна-Уитни. Через 20 недель после иммунизации каждой крысе была проведена интракардиальная перфузия фиксатором Иммунофикс. Сердце и часть аорты были окрашены на липиды суданом III. Другая часть аорты подвергалась гистологическому исследованию, для этого сосуды были залиты в парафин. Срезы, толщиной 6 мкм окрашивали гематоксилином-эозином.
Результаты
Определение нативности ЛПНП, использованных для иммунизации и анализа антител и влияние хранения ЛПНП на их антигенные свойства.
Для оценки нативности ЛПНП, использованных для иммунизации и определения антител, исследовали подвижность ЛПНП в агарозе. Электрофореграмма ЛПНП из ампулы, вскрытой в день анализа, и из ампулы, вскрытой за 3 недели до анализа представлена на рисунке 1.
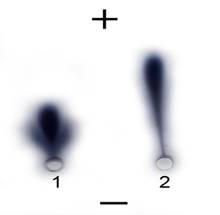
Рис. 1. Электрофореграмма липопротеинов низкой плотности человека.
1 — ЛПНП человека (Sigma) из ампулы, вскрытой в день определения. 2 — ЛПНП человека (Sigma) из ампулы, вскрытой за 3 недели до анализа.
Известно, что нативные ЛПНП имеют низкую подвижность, а по мере окисления подвижность ЛПНП увеличивается. На рисунке 1 видно, что ЛПНП из ампулы, вскрытой в день анализа, в отличие от ЛПНП из ампулы, вскрытой за 3 недели до анализа, имеют низкую подвижность, соответствующую нативным ЛПНП. Таким образом, ЛПНП человека (Sigma), использованные для иммунизации, являются нативными.
Мы заметили, что ЛПНП не только теряют исходные антигенные свойства в ходе хранения после вскрытия ампулы, но и приобретают новые. Так, если для определения антител против ЛПНП ЛПНП были взяты из ампулы, вскрытой в день определения, то наблюдались существенные различия уровня антител к ЛПНП между крысами, иммунизированными ЛПНП и у которых в дальнейшем развился атеросклероз, и контрольными крысами, получившими НАФ (рис. 2).
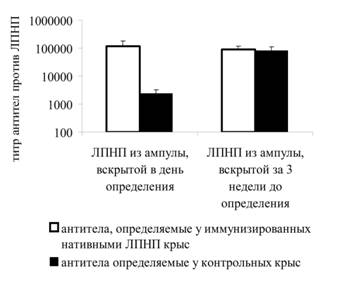
Рис. 2. Уровень антител против ЛПНП из ампулы, вскрытой в день определения и ЛПНП из ампулы, вскрытой за 3 недели до определения у крыс иммунизированных нативными ЛПНП и контрольных крыс.
У крыс, иммунизированных ЛПНП, уровень антител к ЛПНП несоизмеримо выше, чем у крыс получивших НАФ. ЛПНП из ампулы, вскрытой за 3 недели до анализа, не позволяют выявлять различий между сывороткой иммунизированных нативными ЛПНП крыс и контрольных крыс (рис. 2). При этом уровень определеляемых антител является высоким, как у контрольных, так и иммунизированных нативными ЛПНП крыс. Учитывая изменение антигенных свойств ЛПНП при хранении, для иммунизации крыс и анализа антител использовали ЛПНП из ампулы, вскрытой в день иммунизации или анализа соотвественно.
Атеросклеротические изменения у крыс иммунизированных нативными ЛПНП
Однократная иммунизация крыс нативными ЛПНП человека в НАФ в дозе 200 мкг вызвала самоподдерживающийся, самоусиливающийся иммунный ответ против нЛПНП человека (рис. 3).
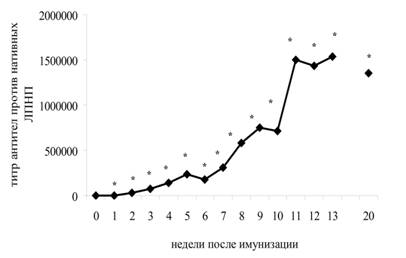
Рис. 3. Кинетика антител против нативных ЛПНП человека. Результаты представлены в виде разницы средних между группой иммунизированных нЛПНП крыс (n=8) и группой контрольных крыс (n=8). * значимые различия по сравнению с контрольными животными p≤0,05, критерий Манна-Уитни.
Каждое новое повышение уровня антител к нативным ЛПНП человека носило спонтанный характер и достигало максимума быстрее, чем предыдущее. Такой характер развития иммунного ответа свойственен для развития реакций гиперчувствительности и аутоиммунных реакций.
Иммунный ответ против нЛПНП человека сопровождался повышением уровня холестерина ЛПНП и снижением холестерина ЛПВП относительно контрольных животных (рис. 4). Таким образом, иммунизация крыс нативными ЛПНП вызывает дислипидемию у крыс.

Рис. 4. Изменение уровня холестерина ЛПНП и холестерина ЛПВП в крови крыс, иммунизированных нативными ЛПНП. Результаты представлены в виде разницы средних между группой иммунизированных нЛПНП крыс (n=8) и группой контрольных крыс (n=8). * значимые различия по сравнению с контрольными животными p≤0,05, критерий Манна-Уитни.
Гистологический анализ аорты крыс, иммунизированных нЛПНП, выявил изменения характерные для атеросклероза. На рис. 5А (справа) видны глубокие нарушения интима-медиа комплекса: участки полного разрушения интимы, дезорганизация, вспучивание и обнажение медии, скопление лейкоцитов в стенке аорты у крыс, иммунизированных нативными ЛПНП. У контрольных крыс, которым однократно вводили НАФ, изменений в структуре аорты не обнаружено (рис. 5А, слева).
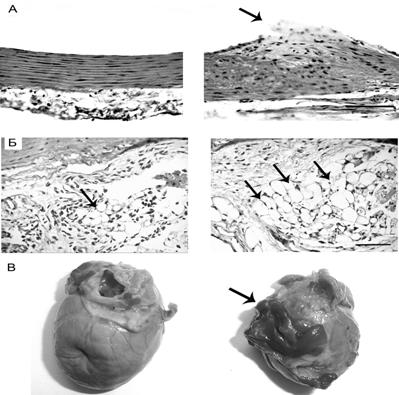
Рис. 5. А. Стенка аорты, окрашенная гематоксилином-эозином; длина линии=1200 μm. Б. Периваскулярная жировая ткань – адипоциты аорты; длина линии = 1400 μm. В. Сердце, окрашенное суданом. Темные области – эпикардиальный жир.
Слева – контрольные крысы, справа – крысы, иммунизированные нЛПНП человека.
Интима аорты крыс представлена в виде единственного эндотелиального слоя, который плотно прилегает к внутренней эластической мембране; медиа аорты состоит из нескольких слоев мышечных клеток и экстрацеллюлярного коллагенового матрикса, разделенного эластиновыми пластинками; адвентиция аорты представлена соединительной и жировой тканью. Таким образом, однократная иммунизация крыс нативными ЛПНП человека в НАФ вызывает повреждения стенки аорты, типичные для атеросклероза.
Иммунизация крыс нативными ЛПНП человека вызвала увеличение объема эпикардиального жира (рис. 5В). На рис. 5В (слева) видно, что сердце контрольного животного почти не имеет эпикардиального жира, тогда как иммунизированные нЛПНП животные демонстрирует его существенный объем (рис. 5В, справа). Увеличение объема эпикардиальной жировой ткани сегодня рассматривают как маркер коронарного атеросклероза и прогностический показатель его развития [3, 8, 9]. Также у иммунизированных ЛПНП крыс, увеличивается количество и размеры адипоцитов белой жировой ткани в адвентициальной оболочке аорты (рис. 5Б, справа). Есть данные, что эпикардиальная и периваскулярная жировая ткань вовлечена в локальную стимуляцию образования атеросклеротических бляшек [8]. Показано, что периваскулярная жировая ткань обладает провоспалительными свойствами и, располагаясь снаружи сосуда, способна вызывать атеросклеротические изменения в его стенке [8].
Таким образом, иммунизация крыс нативными ЛПНП человека вызывает развитие дислипопротеинемии, увеличение объема периваскулярной и эпикардиальной жировой ткани и атеросклеротические повреждения стенки аорты, что свидетельствует о том, что иммунный ответ против нативных липопротеинов низкой плотности является причиной развития атеросклероза.
Список литературы:
1.Меньшиков И.В., Макарова М.И. Булатова и др. Аутоиммунные реакции в патогенезе атеросклероза // Иммунология. 2010. № 5. С. 242—246.
2.Хлюстов В. Н. Количественное определение аутоантител к липопротеинам низкой плотности // Клиническая лабораторная диагностика. 1999. № 4. С. 17—20.
3.Djaberi R, Schuijf JD, van Werkhoven JM, et al. Relation of epicardial adipose tissue to coronary atherosclerosis // Am J Cardiol. 2008. Vol. 102. P. 1602—1607.
4.Gounopoulos P, Merki E, Hansen LF, et al. Antibodies to oxidized low density lipoprotein: epidemiological studies and potential clinical applications in cardiovascular disease // Minerva Cardioangiol. 2007. Vol. 55. P. 821—837.
5.Klimov AN, Nagorrnev VA. Evolution of cholesterol concept of atherogenesis from Anitchkov to our days // Pediatr Pathol Mol Med. 2002. Vol. 21. P. 307—320.
6.Mandal K, Jahangiri M, Xu Q. Autoimmune mechanisms of atherosclerosis // Handb Exp Pharmacol. 2005. Vol. 170. P. 723—743.
7.Virella G and Lopes—Virella MF. Atherogenesis and the humoral immune response to modified lipoproteins // Atherosclerosis. 2008. Vol. 200. P. 239–246.
8.Verhagen SN, Visseren FL, Perivascular adipose tissue as a cause of atherosclerosis //Atherosclerosis. 2011. Vol. 214. P. 3–10.
9.Yorgun H, Canpolat U, Hazırolan T, et al. Epicardial adipose tissue thickness predicts descending thoracic aorta atherosclerosis shown by multidetector computed tomography // Int J Cardiovasc Imaging. 2012. Vol. 28. P. 911—919.
дипломов


Оставить комментарий