Статья опубликована в рамках: XXXII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 01 июля 2015 г.)
Наука: Химия
Секция: Биоорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ПОЛУЧЕНИЕ ТОЗИЛЬНОГО ПРОИЗВОДНОГО КВЕРЦЕТИНА И ЕГО БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Ташенов Ерболат Ордабекович
магистрант специальности «Химия»
Евразийского национального университета им. Л.Н. Гумилева,
Республика Казахстан, г. Астана
E -mail: ero_92_92@mail.ru
Сүлеймен Ерлан Мэлсұлы
канд. хим. наук, PhD, ГНС института прикладной химии доцент кафедры химии Евразийского национального университета им. Л.Н. Гумилева,
Республика Казахстан, г. Астана
E -mail: syerlan75@yandex.kz
Искакова Жанар Бактыбаевна
канд. хим. наук, ВНС института прикладной химии
Евразийского национального университета им. Л.Н. Гумилева,
Республика Казахстан, г. Астана
E -mail: zhanariskakova@mail.ru
Ақатан Қыдырмолла
магистр химии, инженер-исследователь лаб. ЯМР – спектроскопии
Восточно-Казахстанский государственный университет имени С . Аманжолов
Республика Казахстан, г. Усть-Каменогорск
OBTAINING OF TOSYL DERIVATIVE OF QUERCETIN AND ITS BIOLOGICAL ACTIVITY
Tashenov Yerbolat
master student of the chemistry specialty of L.N. Gumilyov Eurasian National University,
Republic of Kazakhstan, Astana
Suleimen Yerlan
candidate of Chem. Science , PhD, Main Researcher of the Institute of Applied Chemistry, Associate Professor of Chemistry Department of L.N. Gumilyov Eurasian National University,
Republic of Kazakhstan, Astana
Iskakova Zhanar
candidate of Chem. Science, Leading Researcher
of the Institute of Applied Chemistry of L.N. Gumilyov Eurasian National University,
Republic of Kazakhstan, Astana
Akatan Kydyrmolla
master of chem. engineer- researcher of the lab. NMR spectroscopy of S. Amanzholov East Kazakhstan State University,
Republic of Kazakhstan, Oskemen
Аннотация
Проведена химическая модификация кверцетина с помощью реакций хлорирования, этерификации стеариновой кислотой и тозилирования. Строение тозильного производного подтверждено спектральными методами. Изучена цитотоксическая активность исходного кверцетина, антиоксидантная активность тозильного производного.
ABSTRACT
Using reactions of chlorination, esterification with stearic acid and tosylation chemical modification of quercetin was realized. The structure of the obtained tosyl derivative was established by spectral methods. Cytotoxic activity of quercetin and antioxidant activity of tosyl derivative were studied.
Ключевые слова: кверцетин; 1Н ЯМР; стеарат кверцетина; тетратозилат; цитотоксическая активность; DPPH.
Keywords: quercetin; 1H NMR; stearate of quercetin; tetratosylate; cytotoxic activity; DPPH.
Встречающийся во многих растениях флаваноид кверцетин (1) относится к полифенольным соединениям и является вторичным метаболитом. Он широко распространен в таких продуктах как овощи, фрукты, чай и вино, а также в многочисленных пищевых добавках, и оказывает благотворное воздействие на здоровье человека [8]. Способность кверцетина (1) захватывать пероксинитриты и гидроксильные радикалы, обладающие высокой реакционной способностью, является доказательством обладания протекторного свойства [5; 7]. Биохимическая активность кверцетина (1) хорошо документированы. Это один из самых мощных антиоксидантов среди полифенолов [4; 9; 10]. Также были продемонстрированы его противовирусные, антибактериальные, противораковые и противовоспалительные эффекты [2; 4; 6]. Антиканцерогенные свойства кверцетина (1) проявляются за счет его значительного воздействия на увеличение апоптоза в мутантных клетках, ингибирование синтеза ДНК, ингибирование роста раковых клеток, снижение и модификация сотовой сигнальной трансдукции [3].
Очистка кверцетина (1)
Для определения чистоты кверцетина (1) был снят его 1Н ЯМР спектр в ДМСО. По данным спектрального анализа выяснилось загрязненность кверцетина рутином.
Определение количества компонентов в смеси с кверцетином (1) проводили с применением метода тонкослойной хроматографии в системе растворителей: этилацетат-уксусная кислота-вода в соотношении 18:1:1. Пластины проявляли УФ-ом и насыщенным раствором хлорида железа (III). После проявления детектором на хроматограмме было обнаружено наличие 2 окрашенных в зеленый цвет зон: Rf = 0,25 (рутин) и Rf = 0,75 (кверцетин (1)).
Очистку кверцетина (1) проводили гель-фильтрацией на колонке. В качестве неподвижной фазы использовали микропористый материал Sephadex LH-20, представляющий собой декстран, молекулы которого соединены химическими связями. В качестве элюента применяли этиловый спирт. Массовое отношение смеси разделяемых веществ к сорбенту было взято в соотношении 1:100. В процессе разделения было зафиксировано образование отдельных друг от друга двух окрашенных в желтый цвет зон. Фракции собирали визуально по образовавшимся окрашенным зонам. При детектировании полученных фракций на ТСХ хроматограмме подтвердилось разделение двух соединений.
1 Н ЯМР-спектр молекулы кверцетина (1) представлен в таблице 1 и соответствует литературным данным [1].
Таблица 1.
Данные ЯМР 1Н (500 МГц, ДМСО, δ, м.д., J/Гц) молекулы кверцетина (1)
|
Атом |
d Н |
Атом |
d Н |
|
6 |
6.18 д (1Н, J=1,6 Гц) |
OH-3 |
10.77 с |
|
8 |
6.40 д (1Н, J=1,6 Гц) |
OH-5 |
12.49 c |
|
2’ |
7.67 д (1Н, J=3,5 Гц) |
OH-7 |
9.58 с |
|
5’ |
6.88 д (1Н, J=9 Гц) |
OH-3’ |
9.35 или 9.29 с. |
Химическая модификация кв ерцетина (1)
· Реакция хлорирования кверцетина (1) газообразным хлором
Хлорпроизводные 3,5,7,3',4' — пентагидроксифлавона получали реакцией газообразного хлора с кверцетином (1) в смеси органических растворителей хлороформ-этанол, взятых в равных соотношениях. Газообразный хлор вводили в реакционную систему сразу после получения его реакцией между перманганатом калия и концентрированной соляной кислотой. В результате были получены предположительно два хлорпроизводных кверцетина (6-монохлоро-(2) (Rf = 0,78), 6,8-дихлорокверцетин (3) (Rf = 0,85)), которые зафиксировали с помощью ТСХ (рисунок 1). Реакция проходила с изменением цвета раствора с бледно желтого на кроваво-красный. Предложен механизм реакции, согласно которой способность к электрофильной атаке молекулами хлора 2',5',6',6,8-положений связана с мезомерным эффектом между неподеленной парой электронов атома кислорода гидроксильной группы и π-электронами бензольного кольца (р, π - коньюгация).
Получение хлора:
2KMnO4 + 16 HCI = 2KCI + 2MnCI2 + 5CI2 + 8H2O

Рисунок 1. Получение хлорпроизводных кверцетина
· Реакция этерификации кверцетина (1) со стеариновой кислотой
Синтез производного кверцетина (1) со стеариновой кислотой проводили в атмосфере аргона, применяя катализаторы DMAP (4-диметиламинопиридин) и EDC (1-этил-3(3-диметиламинопропил) карбодиимид гидрохлорид), использующиеся для связывания кислоты со спиртовой группой. В качестве растворителя применяли тетрагидрофуран (ТГФ). Реакцию проводили в течение 18 часов при 25 оС.
18,78 мг (0,066 ммоль) стеариновой кислоты, растворенный в 2 мл ТГФ, прилили в реакционную колбу с инертной средой, куда предварительно внесли 20 мг (0,066 ммоль) кверцетина (1) и 4 мг (0,033 ммоль) DMAP. Содержимое колбы тщательно перемешивали до полного растворения веществ. К реакционной системе добавили растворенный в 3 мл ТГФ 19 мг (0,1 ммоль) EDC. Ход реакции контролировали методом ТСХ. В результате был получен продукт стеарат кверцетина (4) с Rf = 0,85 (рисунок 2).
После завершения реакции к реакционной смеси прилили 50 мл дистиллированной воды и экстрагировали 50 мл этилацетата. Органическую фазу высушивали над Na2SO4, отфильтровали и концентрировали на роторном испарителе. Концентрат делили на колонке с силикагелем. Продукт реакции не удалось выделить из-за нестабильности соединения (4), разлагающегося в процессе очистки.

Рисунок 2. Получение производного кверцетина (4) со стеариновой кислотой
· Получение тозильного производного кверцетина
Реакцию кверцетина с п-толуолсульфохлоридом проводили в DMF, в присутствии K2CO3. Реакция проходила при комнатной температуре в течение 4,5 ч. В результате была получены смесь тозильных производных кверцетина. Применяя хроматографию удалось выделить тетратозилат кверцетина (5), химическая стуктура которого установлена спектральными методами.
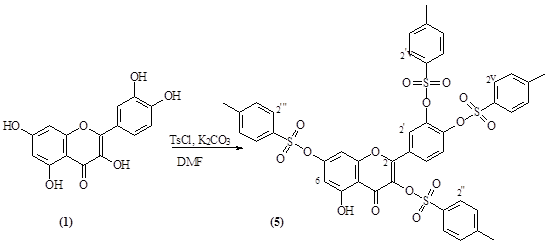
Рисунок 3. Получение тетратозилата кверцетина
· Синтез тетратозилата кверцетина (5):
Прогресс реакции кверцетина с п-толуолсульфохлоридом фиксировали с применением ТСХ в смеси растворителей этанол-хлороформ, взятых в соотношении 1:16. Детектирование соединений на ТСХ пластинке проводили с помощью УФ и насыщенного раствора FeCl3. Колоночную хроматографиию смеси продуктов проводили градиентным элюированием смесью растворителей гексан-этилацетат. Т.пл. определяли на SRS OptiMelt (Automated Melting Point System). ИК-спектры получены на приборе «Cary 600 FT IR». Спектры ЯМР записаны на спектрометре «Bruker DRX-500» (рабочая частота — 500 МГц для 1Н, 125,7 МГц для 13С).
Методика проведения реакции: К раствору кверцетина (1) (150 мг, 0,5 ммоль, 1 экв) в ДМФ (20 мл) добавляли при комнатной температуре карбонат калия (1371,8 мг, 10 ммоль, 20 экв) и тозилхлорид (662,3 мг, 3,5 ммоль, 7 экв). После 4,5 ч реакции, к реакционной смеси прилили дистиллированную воду (75 мл). Продукты реакции экстрагировали этилацетатом (50 мл х 7). Объединенные органические фазы промыли 10%-ым раствором NaCl (100 мл), высушили над Na2SO4, отфильтровали и концентрировали на роторном испарителе. Смесь продуктов делили на колонке с силикагелем. При элюировании 30 %-ым этилацетатом в гексане выделили кристаллы с желтоватым оттенком, 5-гидрокси–3,7,3',4'-тетратозилфлавон (60 мг, 13 %). Тпл=191,5 oС.
ИК -спектр (ν, cм-1): 1650 (C=O), 1350 (O-SO2), 1090 (S=O).
1 Н ЯМР-спектр (δ, 500 МГц, СDCl3): данные представлены в таблице 1 (рис. 4).
13 С ЯМР-спектр (δ, 125,7 МГц, СDCl3): данные представлен в таблице 1 (рис. 5).
Количество тозильных групп определяли по ингеральным ПМР спектра.
Корреляцию спектров проводили с использованием 13С Dept и двумерных спектров 1Н-1Н (COSY), 1Н-13C (HSQC и HMBC).
Таблица 1.
Данные ЯМР 1Н (500 МГц, СDCl3, δ, м.д., J/Гц) и 13С (120 МГц, СDCl3, δ, м.д.) молекулы (5)
|
Атом |
d Н |
d С |
Атом |
d Н |
d С |
|
2 |
— |
161.84 c |
1’’’ |
- |
131.79 |
|
3 |
— |
128.51 с |
2’’’ |
7.24-7.84 м |
128.24-128.62 д |
|
4 |
— |
176.63 c |
3’’’ |
7.24-7.84 м |
129.84-130.37 д |
|
5 |
— |
157.45 c |
4’’’ |
- |
146.24 с, 146.14 с, 146.11 с |
|
6 |
6.40 д (1Н, J=4,1Гц) |
106.22 д |
5’’’ |
7.24-7.84 м |
129.84-130.37 д |
|
7 |
— |
155.44 c |
6’’’ |
7.24-7.84 м |
128.24-128.62 д |
|
8 |
6.82 уш.с. |
101.78 д |
7’’’ |
2.43 c (3H) |
30.85 к |
|
9 |
— |
155.03 c |
1’v |
- |
128.24-128.62 с |
|
10 |
— |
109.59 с |
2’v |
7.24-7.84 м |
128.24-128.62 д |
|
1’ |
— |
128.32 с |
3’v |
7.24-7.84 м |
129.84-130.37 д |
|
2’ |
7.24-7.39 д |
128.24 д |
4’v |
- |
146.24 с, 146.14 с, 146.11 с |
|
3’ |
— |
133.08 с |
5’v |
7.24-7.84 м |
129.84-130.37 д |
|
4’ |
— |
141.45 с |
6’v |
7.24-7.84 м |
128.24-128.62 д |
|
5’ |
7.64-7.84 дд |
124.38 д |
7’v |
2.46 c (3H) |
21.77 к |
|
6’ |
7.64-7.84 д |
124.90 д |
1v |
- |
129.84-130.37 с |
|
1’’ |
— |
130.37 с |
2v |
7.24-7.84 м |
128.24-128.62 д |
|
2’’ |
7.24-7.84 м |
128.24-128.62 д |
3v |
7.24-7.84 м |
129.84-130.37 д |
|
3’’ |
7.24-7.84 м |
132.09 д |
4v |
- |
146.24 с, 146.14 с, 146.11 с |
|
4’’ |
— |
143.98 с |
5v |
7.24-7.84 м |
129.84-130.37 д |
|
5’’ |
7.24-7.84 м |
132.09 д |
6v |
7.24-7.84 м |
128.24-128.62 д |
|
6’’ |
7.24-7.84 м |
128.24-128.62 д |
7v |
2.46 c (3H) |
21.70 к |
|
7’’ |
2.15 c (3H) |
31.57 к |
ОН-5 |
12.0 с |
- |
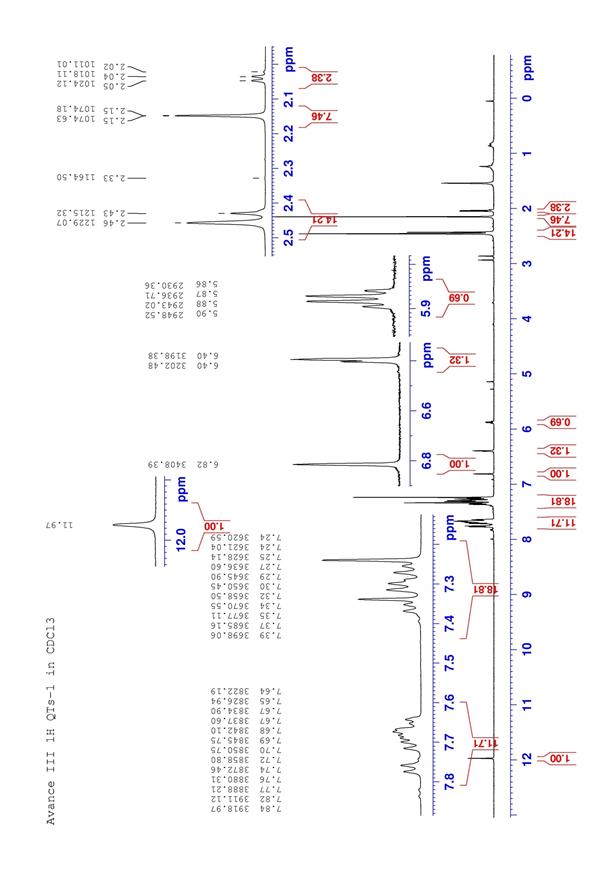
Рисунок 6. 1Н ЯМР спектр 5-гидрокси – 3,7,3',4'- тетратозилфлавона

Рисунок 7. 13С ЯМР спектр 5-гидрокси – 3,7,3',4'- тетратозилфлавона
Определение биологической активности
· Цитотоксическая активность кверцетина (1).
Нами было проведено исследование исходного кверцетина на цитотоксическую активность.
Методика определение цитотоксической активности. Делительную воронку на 55 мл заполняли искусственной морской водой и добавляли 200 мг яиц Artemia salina. Выдерживали в течение 3-х дней при мягкой подаче воздуха, пока рачки не выведутся из яиц. Одну сторону трубы покрывали алюминиевой фольгой, и 5 мин спустя личинки, которые собирались на яркой стороне делительной воронки, вынимали пипеткой Пастера.
20—40 личинок помещали в 990 мл морской воды в каждой из 24 микроплошек. Подсчитывали мертвых личинок под микроскопом. Добавляли по 10 мл раствора диметилсульфоксида на 10 мг/мл образца. В качестве препарата сравнения использовали актиномицин Д или стауроспорин. Для отрицательного контроля добавляли только 10 мл ДМСО. После 24 ч инкубации и дальнейшего выдерживания микроплошки в течение 24 ч (для обеспечения неподвижности) подсчитывали мертвые личинки под микроскопом.
Смертность P определяли по формуле 1:
Р = ( A - N - B)/Z × 1000
где: A — количество мертвых личинок после 24 ч;
N — количество мертвых личинок до проведения теста;
B — среднее количество мертвых личинок в отрицательном контроле;
Z — общее количество личинок.
Данные по цитотоксической активности кверцетина (1) приведены в таблице 2.
Таблица 2 .
Результаты определения цитотоксической активности
|
Параллель |
К-во личинок в контроле (ср) |
К-во личинок в образце (ср) |
% выживших личинок в контроле |
% выживших личинок в образце |
Наличие нейроток сичности, % |
||
|
выж. |
погиб. |
выж |
погиб . |
||||
|
Кверцетин (1) 10 мг/мл |
26 |
1 |
16 |
9 |
96 |
64 |
0 |
|
Кверцетин (1) 5 мг/мл |
26 |
1 |
21 |
4 |
96 |
84 |
0 |
|
Кверцетин (1) 1 мг/мл |
26 |
1 |
27 |
2 |
96 |
93 |
0 |
На основании проведенного эксперимента можно предположить, что кверцетин (1) во всех концентрациях не проявляет цитотоксическую активность.
· Антиоксидантная активность тозильного производного кверцетина (5).
Изучена антиоксидантная активность синтезированного тозильного производного кверцетина (5) DPPH и FRAP методами.
Методика DPPH исследования. Для определения ингибирования 2,2-дифенил-1-пикрилгидразилрадикала (DPPH) к 0,1 мл исследуемого образца в диапазоне концентраций 0,1; 0,25; 0,5; 0,75; 1 мг/мл добавляли 3 мл 6×10‾5М раствора радикала. Центрифужные пробирки находились в штативе, завернутого в черный полиэтилен. После интенсивного перемешивания растворы оставлялись в темноте и через 30 минут производили измерение оптической плотности при длине волны 520 нм. Значения величины антирадикальной активности (АРА) исследуемого соединения (5) определяли по формуле 2:
АРА (%)=А0-А t /А0×100
где: А0 — оптическая плотность контрольной пробы;
Аt — оптическая плотность рабочего раствора.
Измерение оптической плотности исследуемого соединения (5) производили при 520 нм на приборе Cary 60 UV-Vis. Антирадикальную активность тетратозилата кверцетина (5) сравнивали с антирадикальной активностью бутилгидроксианизола (BHA). Значения антирадикального эффекта, рассчитанные по формуле 2, приведены в таблице 3.
Таблица 3.
Антирадикальная активность (%) 5-гидрокси — 3,7,3',4'-тетратозилфлавона (5) при разных концентрациях
|
№ |
Исследуемые вещества |
Концентрация экстрактов (мг/мл) |
||||
|
0,1 |
0,25 |
0,5 |
0,75 |
1,0 |
||
|
1 |
Бутилгидроксианизол (ВНА) |
80,82 |
81,23 |
80,30 |
83,08 |
83,88 |
|
2 |
5-гидрокси-3,7,3',4'- тетратозилфлавон (5) |
7,09 |
6,39 |
3,68 |
3,76 |
7,19 |
На основании анализа данных таблицы 3 и графика (рис. 6) видно, что все исследованные растворы вещества (5) имеют низкую антирадикальную активность по сравнению с ВНА.
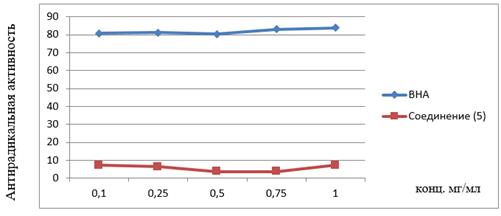
Рисунок 6. Динамика антирадикальной активности при изменении концентрации веществ
Определение железо-восстанавливающего потенциала исследуемых образцов FRAP-методом (Ferric Reducing Antioxidant Powerassay). К 0,1 мл исследуемого вещества (5) в диапазоне концентраций 0,25; 0,5; 0,75; 1,0 мг/мл добавляли 0,25 мл 0,2 М фосфатного буфера (рН=6,6) и 0,25 мл 1 % раствора гексацианоферрата (III) калия. Реакционная смесь инкубировали в течение 20 мин. при 50 0С, реакцию останавливали добавлением 0,25 мл 10 % раствора трихлоруксусной кислоты. Смесь центрифугировали 10 мин. (3000 обор./мин.). Верхний слой объемом 0,5 мл смешивали с 0,5 мл дистиллированной воды и 0,1 мл 0,1 % FeCl3. Измерение оптической плотности (ОП) производили при 700 нм. Антиоксидантную активность (АОА) 5-гидрокси — 3,7,3',4'- тетратозилфлавона (5) сравнивали с АОА бутилгидроксианизола (ВНА).
Таблица 4.
Изменение ОП растворов в зависимости от концентрации рабочих растворов
|
№ |
Образцы |
Величина оптической плотности при концентрации (мг/мл) |
|||
|
0,25 |
0,5 |
0,75 |
1,0 |
||
|
1 |
Бутилгидроксианизол (ВНА) |
1,5538 |
1,5628 |
1,6675 |
1,7438 |
|
2 |
5-гидрокси–3,7,3',4'- тетратозилфлавон (5) |
0,4433 |
0,4330 |
0,4864 |
0,4468 |
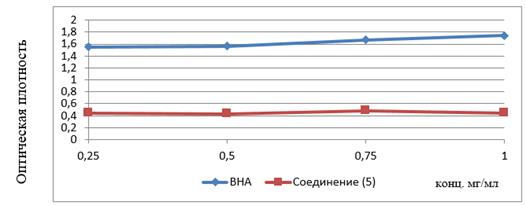
Рисунок 7. Влияние концентрации веществ на изменение антиоксидантной активности
На основании анализа данных таблицы 4 и графика (рис. 7) видно, что исследованное вещество (5) во всех концентрациях имеет низкую АОА по сравнению с бутилгидроксианизолом.
Список литературы:
1.Прибыткова Л.Н., Адекенов С.М. Флавоноиды растений рода Artemisia L. Алматы: Гылым, 1999. — 180 с.
2.Di Carlo G., Mascolo N., Izzo A.A., Capasso F. Flavonoids: old and new aspects of a class of natural therapeutic drugs // Life Sci. — 1999. — № 65. — P. 337—353.
3.Erkoc S., Erkoc F., Keskin N. Theoretical investigation of quercetin and its radical isomers // J. Mol. Struct. — 2003. — № 631. — P. 141—146.
4.Formica J.F., Regelson W. Review of the biology of quercetin and related bioflavonoids // Food Chem. Tox. — 1995. — № 33. — P. 1061—1080.
5.Hanasaki Y., Ogawa S., Fukui S. The correlation between active oxygens scavenging and antioxidative effects of flavonoids // Free Radic. Boil. Med. — 1994. — № 16. — P. 845—850.
6.Harborne J.B., Williams Ch.A. Advances in flavonoid research since 1992 // Phytochemistry. — 2000. — № 55. — P. 481—504.
7.Heijen C.G., Haenen G.R.M.M., van Acker F.A., van der Vijgh W.J., Bast A. Flavonoids as peroxynitrite scavengers: the role of the hydroxyl groups // Toxicol. In Vitro. — 2001. — № 15. — P. 3—6.
8.Kaur Ch., Kapoor H.C. Antioxidants in fruits and vegetables – the millennium’s health // Int. J. Food Sci. Technol. — 2001. — № 36. — P. 703—725.
9.Prior R.L. Fruits and vegetables in the prevention of cellular oxidative damage // Am. J. Clin. Nutr. — 2003. — № 78. — P. 570—578.
10.Rice-Evans C.A., Miller J., Paganga G. Antioxidant properties of phenolic compounds // Trends Plant Sci. — 1997. — № 4. — P. 152—159.
дипломов


Оставить комментарий