Статья опубликована в рамках: XXIV Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 05 ноября 2014 г.)
Наука: Химия
Секция: Органическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
СИНТЕЗ, СТРОЕНИЕ ТРИ- И ТЕТРАКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, РЕАКЦИИ С НУКЛЕОФИЛЬНЫМИ РЕАГЕНТАМИ И КОМПЛЕКСООБРАЗОВАНИЕ С СОЛЯМИ МЕТАЛЛОВ
Кунавина Елена Александровна
канд. хим. наук, доцент кафедры химии Оренбургского
государственного университета, РФ, г. Оренбург
E -mail: дkea20072007@yandex.ru
Козьминых Владислав Олегович
Д-р хим. наук, профессор, зав. кафедрой химии Пермского государственного гуманитарно-педагогического университета, РФ, г. Пермь
SYNTHESIS, STRUCTURE OF THREE- AND TETRACARBONYL COMPOUNDS, REACTIONS WITH NUCLEOPHILIC AGENTS AND COORDINATION WITH METAL SALTS
Elena Kunavina
candidate of Chemical Sciences, Assistant Professor of the Chemical Section of the Orenburg State University, Russia, Orenburg
Vladislav Kozminykh
doctor of Chemical Sciences, Professor, Head of the Chemical Section of the Perm State Humanitarian Pedagogical University, Russia, Perm
АННОТАЦИЯ
Конденсацией Клайзена получены натриевые оксоеноляты три- и тетракарбонильных соединений. Разработаны методы синтеза азагетероциклов с использованием оксоенолятов натрия. Для структурных исследований получены 1,6-дизамещённые 3,4-дигидрокси-2,4-гексадиен-1,6-дионы. Обсуждаются кольчато-цепные и кольчато-кольчатые интерконверсии в растворах тетракарбонильных соединений. Проведены реакции натриевых оксоенолятов с солями металлов(II, III), в результате получены координационные соединения этих металлов. На основании спектральных исследований обсуждаются особенности строения синтезированных соединений.
ABSTRACT
Sodium oxoenolates of three and tetracarbonyl compounds are synthesized by Claisen condensation. Methods of azaheterocycle synthesis using sodium oxoenolates are developed. 1,6-Bis-substituted 3,4-dihydroxyhexa-2,4-diene-1,6-diones are synthesized for structural research. The ring-chain and ring-ring interconversions of tetracarbonyl compounds in solutions are discussed. Reactions of sodium oxoenolates with metal(II, III) salts resulting in preparation of these metal coordination compounds are carried out. The structure peculiarities of synthesized compounds are discussed based on spectral methods investigation.
Ключевые слова: конденсация Клайзена; оксоеноляты натрия; 1,6-дизамещённые 3,4-дигидрокси-2,4-гексадиен-1,6-дионы; гетероциклизация; хинолин-2-карбоновые кислоты; хиноксалины; бензоксазины; комплексообразование; металлохелатные комплексы.
Keywords: Claisen condensation; sodium oxoenolates; 1,6-bis-substituted 3,4-dihydroxyhexa-2,4-diene-1,6-diones; heterocyclization; quinoline-2-carboxylic acids; quinoxalines; benzoxazines; coordination reactions; metal chelate coordination compounds.
Создание новых веществ и материалов с практически полезными свойствами – одна из основных задач органического синтеза. Перспективным направлением в этой области является синтез гетерофункциональных соединений на основе 1,2,4-три- и 1,3,4,6-тетракарбонильных соединений и продуктов их нуклеофильных превращений [1—10]. Синтетические возможности 1,2,4-три- и 1,3,4,6-тетракарбонильных соединений связаны с высокой реакционной способностью, разнообразием таутомерных форм, наличием дополнительных реакционных центров, не характерных для более простых b-дикетонов. Химия натриевых енолятов 1,2,4-три- и 1,3,4,6-тетракарбонильных соединений ранее подробно не изучалась, что определяет перспективы исследования этих соединений в реакциях с нуклеофильными реагентами и в процессах комплексообразования с солями металлов(II, III). Имеющиеся данные о проявлении биологической активности 1,2,4-три-, 1,3,4,6-тетракарбонильных соединений и их структурных аналогов [5—7] являются стимулом для иcследования данных объектов.
Нами изучена конденсация эквимолярных количеств алкил-, арил- и гетерилметилкетонов с диалкилоксалатами (рис. 1). В реакции варьировались различные основания и растворители. В результате получены (2Z)-1-алкокси-1,4-диоксо-2-алкеноляты натрия (1а-м).
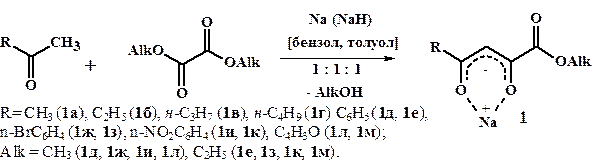
Рисунок 1. Конденсация алкил-, арил- и гетерилметилкетонов с диалкилоксалатами (в эквимолярных соотношениях)
Строение соединений 1 установлено на основании данных ИК и ЯМР 1Н спектроскопии. Показано, что в твёрдом состоянии 4-алкил-(арил-, гетерил)-1-алкокси-1,4-диоксо-2-бутен-2-оляты натрия (1) существуют в виде двух (Z)- и (E)-изомерных форм (1А, 1Б), а в растворах представлены p-p-делокализованными структурами (1В, 1Г) с перераспределённой электронной плотностью металл-хелатного кольца (рис. 2). Так, в ИК спектрах соединений (1) (рис. 3) в твёрдом состоянии наблюдаются полосы валентных колебаний сложноэфирных карбонильных групп (Z)-изомера в области 1707—1730 см-1. В более высокочастотной области 1735—1768 см-1 обнаруживаются менее интенсивные сигналы минорного (Е)-изомера. В растворе хлороформа полосы сливаются и смещаются на 5—10 см-1 в более низкочастотную область, что подтверждает делокализацию структуры. В спектрах ЯМР 1H оксоенолятов натрия (1), снятых в растворах диметилсульфоксида и хлороформа, присутствуют маркерные сигналы (Z)-ориентированных метиновых протонов при 6,35—6,85 м.д. соответствующие преобладающей форме (1В), а также маркерные сигналы (Е)-метиновых протонов при 5,84—6,37 м.д. минорной формы (1Г).
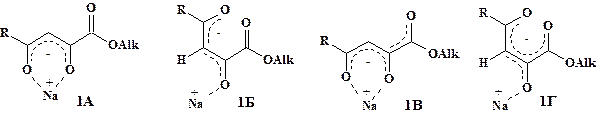
Рисунок 2. Изомерные формы 4-замещённых 1-алкокси-1,4-диоксо-2-бутен-2-олятов натрия (1А-Г)
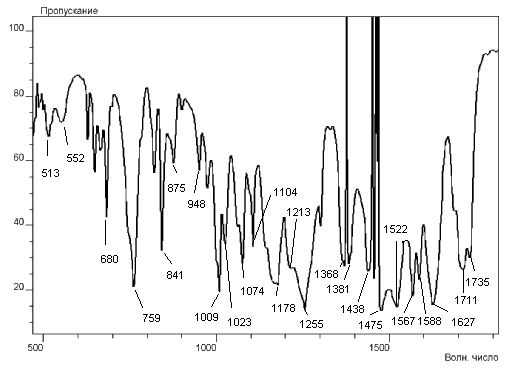
Рисунок 3. ИК спектр натриевого енолята (1з)
Нами изучены реакции натриевых енолятов (1) с моно- и бинуклеофильными реагентами при различных условиях. Обнаружено, что натрий-1,3-дикетонаты (1) не реагируют с нуклеофилами в нейтральной и основной среде, но эти реакции удаётся осуществить в присутствии кислот. Выделить продукты реакций алкиламинов и монофункциональных ариламинов с соединениями (1) не удалось из-за значительного смолообразования. Однако сравнительно легко протекают реакции натрий-оксоенолятов с бифункциональными нуклеофилами. Так, впервые осуществлена трёхкомпонентная конденсация эквимолярных количеств алкил-, арил- или 2-фурилметилкетонов и диэтилоксалата в присутствии натрия с последующим нагреванием реакционной смеси в среде уксусной кислоты и действием м-аминофенола или м-фенилендиамина. В результате реакции получены 7-гидрокси- или 7-аминозамещённые 4-(гет)арил- и 4-алкилхинолин-2-карбоновые кислоты (2а-г) а в ряде случаев – их эфиры (3а-в) (рис. 4). Спектральные характеристики синтезированных соединений (2, 3) хорошо согласуются со строением производных хинолин-2-карбоновых кислот. Фенольная гидроксильная группа в положении С7-ОН и аминогруппа С7-NH2 бензольного кольца в случае кислот (2) связана межмолекулярной водородной связью (МВС) с карбоксильной функцией, что подтверждается соответствующим низкочастотным поглощением около 3180—3185 см-1 и 1648—1674 см-1 в ИК спектрах этих соединений.
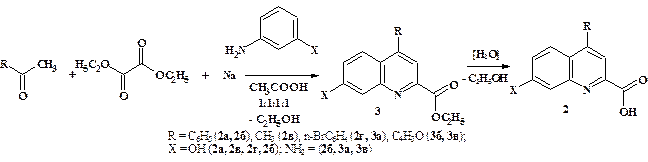
Рисунок 4. Синтез 7-аминозамещённых 4-(гет)арил- и 4-алкилхинолин-2-карбоновых кислот (2а-г) и их эфиров (3а-в)
Наличие в спектре ЯМР 1Н соединений (2, 3) двух синглетов с химическими сдвигами при 7,14-8,21 м.д. указывает на присутствие двух ароматических метиновых групп С8Н и С3Н, изолированных от соседства с другими протонами, и полностью подтверждает строение 4,7-дизамещённых хинальдиновых кислот и их эфиров (2, 3).
Нами изучена трёхкомпонентная конденсация n-нитроацетофенона и 2-ацетилфурана с диэтилоксалатом и 1,2-диаминобензолом, а также 1,2-аминофенолом (рис. 5). В результате реакции выделены (3Z)-3-[2-(4-нитрофенил)-2-оксоэтилиден]-3,4-дигидрохиноксалин-2(1Н)-он (4а) и (3Z)-3-[2-(4-нитрофенил)-2-оксоэтилиден]-3,4-дигидро-2Н-1,4-бензоксазин-2-он (4б), (3Z)-3-[2-(фурил)-2-оксоэтилиден]-3,4-дигидрохиноксалин-2(1Н)-он (4в) и (3Z)-3-[2-(фурил)-2-оксоэтилиден]-3,4-дигидро-2Н-1,4-бензоксазин-2-он (4г), соответственно.
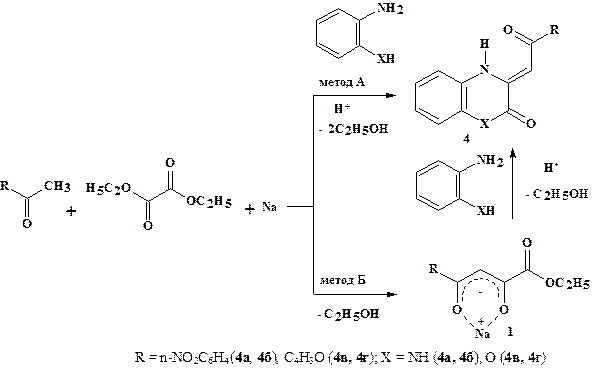
Рисунок 5. Трёхкомпонентная конденсация метилкетонов с диэтилоксалатом и 1,2-диаминобензолом или 1,2-аминофенолом
Предложенный метод получения хиноксалинов и бензоксазинов характеризуется простотой и удобством, что связано с сокращением числа стадий проведения реакции по сравнению с известными методами получения структурных аналогов и позволяет получать широкий ряд близких по структуре азагетероциклов. Технологически менее эффективным является метод Б, отличающийся от вышеописанного стадией выделения натрий-оксоенолятов (1), с последующим вовлечением их во взаимодействие с О,N- и N,N-бинуклеофильными реагентами.
Осуществлена реакция комплексообразования синтезированных натрий-оксоенолятов (1) с солями металлов(II,III), в результате которой выделены металло(II,III)хелатные комплексы (5а-я).
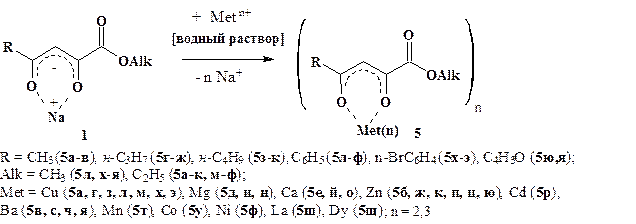
Рисунок 6. Комплексообразование натрий-оксоенолятов (1) с солями металлов(II ,III). Синтез металлохелатных комплексов (5)
Структура координационных соединений (5) установлена с помощью методов ИК и ЯМР 1Н спектроскопии. В ИК спектрах комплексов (5а-я), снятых в пасте вазелинового масла и хлороформе, присутствует интенсивная полоса валентных колебаний сложноэфирной карбонильной группы в области 1693—1736 см-1, а также интенсивная уширенная полоса колебаний групп C-O-Met и C-C металлохелатных колец при 1566—1650 см-1.
В спектрах ЯМР 1Н в ожидаемых областях наблюдаются триплетные сигналы протонов групп СН3 этокси-звена при 1,05—1,32 м.д. Синглеты метильных протонов метокси-группы находятся в области 3,59—3,94 м.д., квадруплеты протонов метиленовых групп СН2 сложноэфирной группы находятся в области 3,74—4,25 м.д., синглеты протонов метиновых групп при 5,17—6,72 м.д., мультиплетные сигналы ароматических протонов при 6,62—8,04 м.д.
На основании спектральных данных установлено, что металлокомплексы (5а-я) имеют структуру (Z)-изомеров. В спектрах ЯМР 1Н бариевых (5ч, я) и лантанового (5ш) комплексов присутствует дополнительно незначительное количество (Е)-изомера. Для бариевого комплекса (5с) впервые обнаружены помимо основного (Z)-изомера минорные (E')-2-OBa- (13%) и (E'')-4-OBa- (3 %) изомерные формы, рассчитано их относительное содержание (рис. 7).

Рисунок 7. Изомерные формы бариевого комплекса (5с)
Впервые получены бис-1,3-диеноляты натрия (6) с одинаковыми и различающимися заместителями (рис. 8). Конденсация метилкетонов с диэтилоксалатом в присутствии натрия или гидрида натрия в среде толуола проводилась при соотношении исходных реагентов 1:1:1:2.
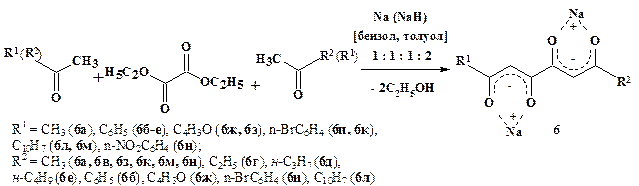
Рисунок 8. Конденсация метилкетонов с диэтилоксалатом в синтезе бис-1,3-диенолятов натрия (6)
Бис -натрий-1,3-дикетонаты (6) характеризуются существенным структурным разнообразием. В ИК спектрах соединений (6), в твердом состоянии наблюдается уширенная полоса в области 1569—1710 см-1, соответствующая колебаниям карбонильной группы, сопряженной с двойной связью в бис-ОNa-хелате.
Анализ спектров ЯМР 1Н показывает, что соединения (6) представлены в растворе ДМСО-d6 смесью двух (2Z,4Z)- и (2Z,4E)-изомерных форм, что подтверждается присутствием маркерных сигналов (Z)-метиновых протонов в области 6,20—7,72 м.д. доминирующего изомера, а также минорных сигналов (2Z,4E)-изомера при 5,58—5,62 м.д.
Для изучения цепных и кольчато-цепных таутомерных равновесий в растворах тетракарбонильных соединений подкислением бис-1,3-диенолятов натрия (6) нами получены 1,6-дизамещённые 3,4-дигидрокси-2,4-гексадиен-1,6-дионы (7) (рис. 9).
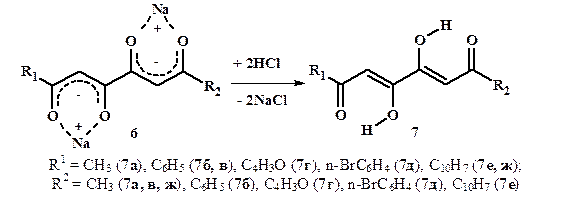
Рисунок 9. Синтез 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов (7)
Соединения (7а-в, 7д, 7е) были получены ранее, но подробные структурные исследования не проводились. Известные методы получения веществ (7в) и (7е) трудно воспроизводимы и, как правило, не являются препаративными.
Согласно спектральным данным строение соединений (7а-ж) отличается значительным структурным разнообразием (рис. 10). На основании спектров ЯМР 1Н было установлено, что большинство 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов (7) с различающимися заместителями в растворе хлороформа существуют преимущественно в виде диенольного таутомера A и в незначительном количестве в форме минорных таутомеров Б и В. В диметилсульфоксиде преобладают кольчатые региоизомеры Г и Д. В спектре соединения (7в) впервые обнаружен минорный изомер Е.
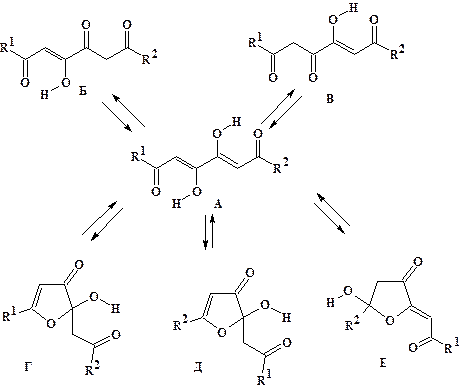
Рисунок 10. Структурное разнообразие, кольчато-цепная и кольчато-кольчатая таутомерия соединений (7: формы А-Е)
Изучена реакция гетероциклизации 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов с о-фенилендиамином (рис. 11). Выделены и описаны 2,3-бис[(2-фуроил)метил]хиноксалин (8а), 2,3-бис[(2-нафтоил)метил]хиноксалин (8б) и (1Z)-1-[(3Z)-3-[2-оксо-2-(5,6,7,8-тетрагидронафтоил)этилиден]-3,4-дигидроксихиноксалин-2(1H)-илиден]пропан-2-oн (8в). Реакция протекает в среде этанола в присутствии каталитических количеств уксусной кислоты при кратковременном нагревании.
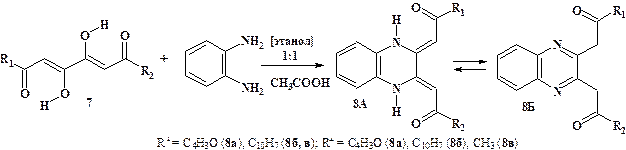
Рисунок 11. Гетероциклизация 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов (7) при действии о-фенилендиамина. Синтез производных хиноксалина (8)
Согласно спектральным данным соединения (8а-в) в твёрдом состоянии и в растворе хлороформа представлены формой 8А. Сигналы, соответствующие имино-таутомеру 8Б, в ИК и ЯМР 1Н спектрах нами не обнаружены.
В ИК спектрах соединений (8а-в) наблюдаются слабые низкочастотные пики поглощения групп NH хиноксалинового кольца в области 3043—3173 см-1, а также малоинтенсивные низкочастотные полосы поглощения карбонильных групп енаминокарбонильного звена. Данный факт свидетельствует о наличии в структурах устойчивой NH-хелатной внутримолекулярной водородной связи (ВВС).
Присутствие маркерных сигналов протонов метиновых групп CH при 5,89—6,73 м.д в спектрах ЯМР 1Н, снятых в растворе дейтерохлороформа, подтверждает наличие енамино-таутомера А и позволяет с уверенностью отвергнуть альтернативную имино-форму Б (рис. 11). В пользу формы А свидетельствуют также сигналы протонов вторичных аминогрупп хиноксалинового кольца в области 14,54—15,22 м.д.
Установлено, что металло-1,3-дикетонаты на основе три- и тетракарбонильных соединений обладают ростостимулирующей и бактериостатической активностью. Так, выявлена ростостимулирующая активность натриевых енолятов (1a) и (1е) по отношению к различным сортам пшеницы (Оренбургская 105, Юго-Восточная 2) и картофелю (Невский). Изучено действие енолятов в диапазоне концентраций 102—10-11 г/т на рост, урожайность и качество зерна пшеницы. Выявлены эффективные нормы расхода соединения при предпосевной обработке семян, составляющие 10-3, 10-5 г/т для соединения (1а) и 10-2, 10-5 г/т для соединения (1е). Для соединений (1а), (5б) и (5ж) обнаружено бактериостатическое действие в отношении штаммов золотистого стафилококка Staphylococcus aureus и кишечной палочки Escherichia coli.
Таким образом, нами изучена конденсация метилкетонов с диалкилоксалатами в присутствии конденсирующих агентов при различных соотношениях исходных соединений, в результате которой получены новые натриевые еноляты оксопроизводных 1,3-дикарбонильных соединений. Синтезированы устойчивые металло(II,III)хелатные комплексы из оксоенолятов натрия. Изучено взаимодействие оксоенолятов натрия с о-фенилендиамином и о-аминофенолом. Синтезированы новые 1,6-дизамещённые 3,4-дигидрокси-2,4-гексадиен-1,6-дионы, изучены их структурные особенности. Для некоторых тетракарбонильных систем выявлены ранее не описанные формы. Изучены реакции гетероциклизации 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов с о-фенилендиамином, в результате которых получены новые 2,3-бис-оксоилиденхиноксалины. Структурные особенности синтезированных соединений установлены на основании данных спектральных методов анализа. Выявлена биологическая активность для некоторых представителей натриевых оксоенолятов.
Список литературы:
1.Виноградов А.Н., Козьминых В.О., Козьминых Е.Н. Синтез эфиров 5-гидрокси-4,5-дигидроизоксазол-3-карбоновых кислот // Башкирский химический журнал. — 2014. — Т. 21. — № 2. — С. 104—106.
2.Карманова О.Г., Козьминых В.О., Муковоз П.П., Козьминых Е.Н. Синтез и структурное разнообразие 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов // Известия высших учебных заведений. Химия и химическая технология. Иваново: Изд-во ИГХТУ, — 2013. — Т. 56. — № 1. — С. 13—16.
3.Кириллова Е.А., Жадяев А.В., Козьминых В.О. Синтез и особенности строения металлохелатных комплексов на основе трикарбонильных соединений // Вестник Оренбургского гос. ун-та. Оренбург: Изд-во ОГУ, — 2013. — Вып. 10 (159). — С. 139—141.
4.Кириллова Е.А., Муковоз П.П., Виноградов А.Н., Козьминых В.О., Дворская О.Н. Синтез, особенности строения и таутомерия 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов // Известия высших учебных заведений. Химия и химическая технология. Иваново: Изд-во ИГХТУ, — 2011. — Т. 54. — № 4. — С. 18—22.
5.Козьминых В.О., Гончаров В.И., Козьминых Е.Н. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 3) // Вестник Оренбургского гос. ун-та. Оренбург, — 2007. — Вып. 5 (69). — С. 138—148.
6.Козьминых Е.Н., Гончаров В.И., Козьминых В.О. 1,3,4,6-Тетракарбонильные системы. Сообщение 8. Синтез и противомикробная активность 2(5)-галогенпроизводных 1,3,4,6-тетракарбонильных соединений // Химико-фармацевтический журнал. — 2008. — Т. 42. — № 9. — С. 18—24.
7.Левенец Т.В., Козьминых В.О. Синтез и противомикробная активность эфиров 3-арилгидразоно-2,4-диоксоалкановых кислот // Химико-фармацевтический журнал. — 2013. — Т. 47. — № 10. — С. 25—29.
8.Муковоз П.П., Тарасова В.А., Карманова О.Г., Козьминых В.О. Строение и таутомерия 1,6-диалкилзамещённых 1,3,4,6-тетраоксосистем и их ближайших азоаналогов (обзор) // Известия высших учебных заведений. Поволжский регион. Естественные науки. Пенза: Пензенский гос. ун-т, — 2013. — № 4 (4). — С. 91—107.
9.Тарасова В.А., Муковоз П.П., Козьминых В.О. Синтез и строение диалкил-2,2'-(2-оксоимидазолидин-4,5-диилиден)диацетатов // Приволжский научный вестник. Научно-практический журнал. Ижевск: Изд-во «Издательский Центр Научного Просвещения», — 2014. — № 9 (37). — С. 10—13.
10.Тарасова В.А., Муковоз П.П., Козьминых В.О. Синтез метиловых эфиров 3,4-дигидрокси-6-оксо-2,4-алкадиеновых кислот // Вестник Южно-Уральского гос. ун-та. Серия "Химия". Челябинск, — 2014. — Т. 6. — № 3. — С. 11—16.
дипломов


Оставить комментарий