Статья опубликована в рамках: L Международной научно-практической конференции «Инновации в науке» (Россия, г. Новосибирск, 28 октября 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
ПЕРЕРАБОТКА СОЛЕСОДЕРЖАЩИХ ОТХОДОВ, ОБРАЗУЮЩИХСЯ В ПРОЦЕССЕ НИТРОЗИРОВАНИЯ ДИАЛКИЛАМИНОВ
Ласкин Борис Михайлович
д-р техн. наук, профессор, начальник лаборатории
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: bmlaskin@mail.ru
Вознюк Олеся Николаевна
канд. хим. наук, научный сотрудник
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: voznuk.olesia@yandex.ru
Мухортов Дмитрий Анатольевич
канд. техн. наук, начальник отдела
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: dmukhortov@mail.ru
Камбур Марина Павловна
научный сотрудник
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: mkambur@mail.ru
Петров Валентин Борисович
старший научный сотрудник
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: valentinpetrov46@mail.ru
Алексеев Юрий Иванович
ведущий инженер
ФГУП «РНЦ «Прикладная химия»,
РФ, г. Санкт-Петербург
E-mail: alexeev-588@yandex.ru
RECYCLING OF SALT-CONTAINING WASTES FROM A NITROSATION OF DIALCYLAMINES
Boris Laskin
doctor of Science, Professor, head of a lab,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
Olesia Voznuk
candidate of Science, researcher,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
Dmitriy Mukhortov
candidate of Science, head of a department,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
Marina Kambur
researcher,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
Valentin Petrov
senior researcher,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
Yuriy Alexeev
leading engineer,
FSUE “RSC “Applied Chemistry”,
Russia, Saint Petersburg
АННОТАЦИЯ
С целью разработки технологии переработки отходов нитрозирования органических соединений, представляющих собой водный раствор сульфата натрия с примесью нитрата натрия и нитрита натрия, экспериментально исследован процесс денитрации солесодержащих растворов путем взаимодействия нитрата натрия с бисульфатом натрия с последующей испарением образующейся азотной кислоты при высокотемпературной обработке.
AbStRact
For the purpose of a recycling technology development of wastes from a nitrosation of dialcylamines (water solution of sodium sulafate, sodium nitrate and sodium nitrite), process of a salt-containing solutions denitration is experimentally investigated. The denitration is lead by interaction sodium nitrate and sodium bisulphate and following high-temperature treating of an obtained solution with elimination of nitric acid.
Ключевые слова: сульфат натрия; нитрат натрия; нитрит натрия; бисульфат натрия; очистка.
Keywords: sodium sulphate; sodium nitrate; sodium nitrite; sodium bisulphate; refinement.
Современное производство N-диалкилнитрозоаминов, общей формулой R1R2NNO, где R1, R2 — алкильный радикал, основано на методе получения N-диалкилнитрозоаминов путем нитрозировавния диалкиламинов нитритом натрия в присутствии серной кислоты (1) [1, с. 199—201].
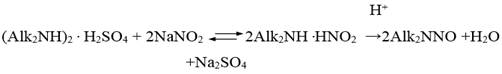 (1)
(1)
Alk – Me, Et, n-Pr, i-Pr и др.
Помимо основной реакции нитрозирования диалкиламинов, в реакционной среде протекает параллельные реакции (2, 3, 4):
2NaNO2 + H2SO4→ 2HNO2 + Na2SO4 (2)
3HNO2→HNO3+2NO+H2O (3)
NaNO2 +HNO3→ HNO2+ NaNО3 (4)
В связи с протеканием побочных реакций (2—3) процесс нитрозирования диалкиламинов проводят при избытке нитрита натрия, который может достигать величины 20 %.
Из реакционной массы нитрозодиалкиламины выделяют ректификацией в виде дистиллята в смеси с водой, а в кубе колонны образуется водный раствор солей с концентрацией порядка 30 %, дальнейшая переработка которого приводит к получению низкокачественного сульфата натрия, загрязненного примесями нитрата и нитрита натрия.
Для решения этой проблемы был предложен эффективный метод очистки сульфата натрия от нитрита и нитрата натрия путем введения в солесодержащие растворы серной кислоты с образованием бисульфата натрия, который при последующем нагревании до 200 oС после испарения воды взаимодействует с нитратом натрия с испарением образующейся азотной кислоты. При этом нитрит натрия полностью разлагается на стадии образования бисульфата натрия по уравнению (5).
2NaHSO4 + 3NaNO2 → 2Nа2SO4+ NaNО3 + H2O+ 2NO (5)
В результате экспериментальных исследований было установлено, что процесс получения высококачественного сульфата натрия из солесодержащих отходов, образующихся в процессе нитрозирования диалкиламинов, можно осуществить в три основные стадии – получение бисульфата натрия в рабочем растворе, выпаривание воды и высокотемпературная обработка сухих солей. Необходимость разделения процесса денитрации солесодержащих отходов по стадиям обусловлена тем, что образование бисульфата натрия протекает в водной среде при температурах 45—60 оС, а процесс вытеснения азотной кислоты идет при температуре выше 200 оС и реализация этого процесса в водных растворах не представляется возможной.
Образование в реакционной среде бисульфата натрия достигается путем добавления в исходный раствор расчетного количества серной кислоты (6).
![]() (6)
(6)
Количество серной кислоты рассчитывается исходя из содержания в исходном растворе нитрата и нитрита натрия по уравнениям (5, 7).
![]() (7)
(7)
В результате проведенных исследований было установлено, что содержащийся в растворе нитрит натрия на стадии подкисления рабочих растворов разлагается с конверсией 84—97 % по уравнению (5).
В таблице 1 представлены результаты экспериментов по разложению нитрита натрия при подкислении солесодержащих растворов серной кислотой.
Таблица 1.
Разложение водных растворов нитрита натрия при подкислении солесодержащих растворов серной кислотой
|
№ п/п |
Максимальная температура опыта, ºС |
Средняя скорость нагрева, ºС/ мин |
Время выдержки при максимальной температуре, мин |
Конверсия нитрита натрия, % |
1 |
46 |
0,60 |
20,5 |
84,0 |
2 |
51 |
0,65 |
13 |
85,2 |
3 |
57 |
0,54 |
0 |
85,0 |
4 |
60 |
0,90 |
12 |
97,8 |
Полученные рабочие растворы, содержащие бисульфат и нитрат натрия, подвергали выпарки до остаточного содержания воды 10—15 %. Затем образующуюся смесь солей подвергли высокотемпературной обработке при температуре 190—230 оС. Установлено, что при подобной обработке солевых смесей нитрат натрия активно реагирует с бисульфатом натрия (7) с конверсией 83—90 %.
Результаты экспериментов по термической обработки сухой смеси солей, содержащих нитрат натрия, средний и кислый сульфат натрия, представлены в таблице 2.
Таблица 2.
Результаты экспериментов по термической обработке сухой смеси солей, содержащих нитрат натрия, средний и кислый сульфат натрия
|
|
|
|
|
|
|
|
|
|
|
|
|
88 |
|
|
|
|
|
|
87 |
|
|
|
|
|
|
90 |
|
|
|
|
|
|
98 |
|
|
|
|
|
|
87 |
|
|
|
|
|
|
51 |
|
|
|
|
|
|
49 |
Результаты, приведенные в таблице 2, показывают при температуре от 200 до 230 °С и времени пребывания не менее 10 минут конверсия нитрата натрия составляет от 87 до 98 % и полученный в результате термической обработки сульфат натрия соответствует ТУ 2141-114-05766575-2004 по остаточному содержанию нитрата натрия, величина которого не должна превышать 1,5 %. В ряде опытов (№№ 1—5) содержание нитрата натрия не превышает 1,0 %. Дальнейшее увеличение температуры не приводит к увеличению конверсии нитрата натрия, и поэтому не является целесообразным.
Снижение температуры до 135—200 °С приводит к уменьшению конверсии нитрата натрия, что ухудшает качество полученного сульфата натрия. Так в опытах при температуре от 135 до 211 °С конверсия нитрата натрия составила от 49 до 51 %.
При этом было показано, что образующаяся в результате этого процесса азотная кислота эвакуируется из реакционной среды, что предотвращает от повторного загрязнения сульфата натрия.
Наряду с основным процессом в реакторе термической обработки может происходить частичное разложение паров азотной кислоты [2; 3] с образованием диоксида азота и кислорода.
2HNO3 ® H2O + 2NO2 + 0,5O2 (8)
Возможно также разложение диоксида азота до оксида азота и кислорода по уравнению (9):
2NO2 ® 2NO + O2 (9)
В результате экспериментальных исследований было показана возможность абсорбционного улавливания паров азотной кислоты водными растворами аммиака, гидроксидами и карбонатами щелочных металлов. Кроме того выяснено, что в условиях термической обработки смеси солей при температуре 200—220 оС, образующиеся пары азотной кислоты разлагаются на 5—18 % в зависимости от времени пребывания паров в интервале 3—15 минут.
Практическая значимость предложенного метода очистки сульфата натрия от примесей нитрита и нитрата натрия заключается в возможности получения товарного сульфата натрия и товарных нитратов.
Результаты, приведенные в настоящем материале, выполнены при финансовой поддержке Министерства образования и науки РФ. Уникальный идентификатор прикладных научных исследований и экспериментальных разработок RFMEFI62514X0019.
Список литературы:
- Синтез органических препаратов. В 12 Сб. Сб. 2 / под ред. Б.А. Казанского. — М.: Иностр. Лит., 1949. — 655 с.
- Johnston H.S., Foering L., Tao Y.S., and Messerly G.H. The kinetics of the thermal decomposition of nitric acid vapor // J. Amer. Chem. Soc. — 1951. — Vol. 73. — № 5, — P. 2319—2321.
- Ellis W.R., Murray R.C. The thermal decomposition of anhydrous nitric acid vapour // J. appl. Chem. — 1953. — Vol. 3. — № 7. — P. 318—321.
дипломов


Оставить комментарий