Статья опубликована в рамках: I Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 28 сентября 2011 г.)
Наука: Медицина
Секция: Кардиология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ ЛЕГОЧНОЙ ТКАНИ У КРЫС СО СПОНТАННОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ
Кирсанова Марина Петровна
Ужгородский национальный университет, факультет последипломного образования, кафедра пульмонологии и фтизиатрии, Украина, г. Ужгород
На сегодня значительный интерес представляет проблема сочетанной кардиопульмональной патологии в связи с ее большой распространенностью. Особое внимание уделяется изучению патогенетических механизмов взаимного отягощения при ишемической болезни сердца, артериальной гипертензии (АГ) и хроническом обструктивном заболевании легких (ХОБЛ) [1, с. 62; 4, с. 20–23; 10, Р. 1514–1519]. В результате тесной функциональной связи между системами кровообращения и дыхания при нарушении функции одной из систем возникает синдром взаимного отягощения. При заболеваниях сердечно-сосудистой системы и недостаточности кровообращения используется дыхательный резерв и, напротив, при легочной недостаточности в процессы компенсации включаются гемодинамические факторы [2, с. 5]. Известно, что при развитии артериальной гипертензии возникает нарушение функции внешнего дыхания, изменения бронхиальной проходимости, и даже, возможно, формирование кислородной недостаточности, которое нуждается в применении оксигенотерапии [3, с. 36–37; 5, с. 34–35; 6, с. 79–81]. Вместе с тем, механизмы развития изменений в легких при ессенциальной артериальной гипертензии остаются мало изученными. Изучение структурных и связанных с ними метаболических изменений в органах дыхательной системы, учитывая клинические и лабораторные данные, является необходимым шагом в определении природы легочной дисфункции при ессенциальной гипертензии и разработке путей коррекции данных нарушений.
Целью работы было изучение морфологических особенностей легочной ткани у крыс со спонтанной артериальной гипертензией (САГ).
Материалы и методы. Исследование проводилось на гипертензивных крысах линии SHR (n=20) и нормотензивных крысах линии Вистар (n=5) – контрольная группа. В эксперименте использовались крысы возрастом 3 месяца весом 230-300 г. Животные содержались отдельно в специализированных клетках на стандартном пищевом рационе в условиях свободного доступа к еде и воде. Их акклиматизировали к условиям комнаты для проведения исследований. После умертвления животных легкие удалялись полностью. При проведении микроскопического исследования органы фиксировали в 10% растворе формалина, промывали под проточной водой, дегидратировали в спиртах растущей концентрации и окунали в парафин. После фиксации из всех трех долей вырезались кусочки – поперечные фрагменты долевых, сегментарных бронхов, уровень их бифуркации, фрагменты последующих генераций бронхов вдоль всего разветвления до уровня мелких бронхов и бронхиол вместе с легочной паренхимой. На микротоме изготовлялись срезы толщиной 5-7 мкм, которые были окрашены гематоксилином и эозином, а также пикрофуксином за Ван Гизоном. На монитор компьютера изображения выводили из микроскопа Zeiss Canon с помощью видеокамеры Axio Vision Camera и программы Inter Video WINDVR.
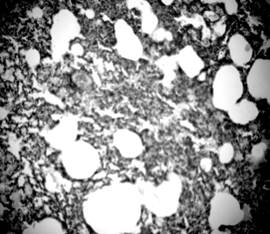
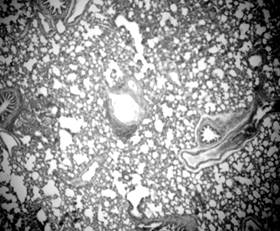
Результаты исследования и их обсуждение. Проведенное морфологическое исследование микропрепаратов легких показало, что у животных со САГ, в сравнении с контрольной группой, имеют место изменения практически всех структурных компонентов легочной ткани. Стенка сегментарных бронхов была деформированной и утолщенной за счет разрастания соединительной ткани. Некоторые бронхи были спазмированы и имели фестончатую слизистую оболочку (рис. 1), а отдельные – имели неравномерно расширенный просвет. Увеличенное количество соединительной ткани в стенках бронхов (рис. 2) могло способствовать прогрессированию их стеноза и приводить к расширению респираторных бронхиол, альвеолярных ходов. В результате таких изменений уменьшалась площадь альвеолярной поверхности легких за счет повреждения эластичного каркаса межальвеолярных перегородок и возникали очаговые эмфизематозные изменения (рис. 3).
Рисунок 1. Спазм стенки бронха. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: об. х20, ок. х10.

Рисунок 2. Склеротические изменения сосудистой стенки и стенки бронха. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска по Ван Гизону. Микрофото. Ув.: о. х40, ок. х10.

Рисунок 3. Разрыв альвеолярных перегородок, участки ателектаза. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: о. х20, ок. х10.
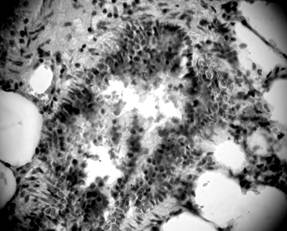
В экспериментальных животных, кроме сужения просвета бронхов, также были выявлены увеличение продукции слизи и слизистые пробки (рис. 4, 5), что свидетельствует о нарушении дренажной функции дыхательных путей. Наблюдались изменения в слизистой оболочке, в частности, собственная пластинка слизистой некоторых бронхов имела участки лимфогистиоцитарной инфильтрации. В отдельных случаях отмечалось скопление лимфоцитов по ходу бронхиол, инфильтрация ими стенки и сужение в таких участках просвета дыхательных путей, что могло способствовать появлению обструктивных изменений, ухудшать вентиляцию легочной ткани и, как следствие, приводить к развитию фиброзных изменений. В просвете бронхов располагались пласты слущенного эпителия и секрет с примесями десквамированого бронхиального эпителия (рис. 5).
Рисунок 4. Обструкция бронха слизистой пробкой. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: о. х40, ок. х10.

Рисунок 5. Десквамация эпителия, секрет с примесями слущеных эпителиоцитов. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: о. х40, ок. х10.
Лимфоидные инфильтраты разных размеров были локализированы как вокруг бронхов, так и вокруг стенок сосудов (рис. 6, 7). Выраженных структурных изменений со стороны микроциркуляторного русла не наблюдалось. Просвет капилляров был заполнен форменними элементами крови, в основном – эритроцитами с одиночными нейтрофилами.
Рисунок 6. Перибронхиальная лимфоидная инфильтрация. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: о. х20, ок. х10.

Рисунок 7. Периваскулярная лимфоидная инфильтрация. Срез легких 3-месячной крысы со спонтанной артериальной гипертензией. Окраска гематоксилин-эозином. Микрофото. Ув.: о. х20, ок. х10.
Появление лимфоидных очагов, которые выявлялись в каждом срезе, можно объяснить иммунологическими изменениями, вероятнее всего, иммуносупрессией, застоем слизи в бронхах или же изменениями коагуляционных свойств крови, которые являются характерными для данной линии животных [7, Р. 197–198; 8, Р. 724–726; 9, Р. 2118–2121]. Диффузные и очаговые инфильтраты в стенке бронхов по мере развития животных могут быть структурной основой для поддержки персистирующего воспалительного процесса в легких, особенно при действии внешних факторов (табачный дым и т.д.), с последующим прогресированием хронического воспаления и обструкции дыхательных путей.
Выявленые у подопытных животных признаки обструкции бронхов (рис. 1, 4, 5), эмфизематозные изменения (рис. 3), периваскулярный и перибронхиальный склероз (рис. 2), лимфоидные инфильтраты (рис. 6, 7), вероятнее всего, указывают на развитие хронического обструктивного бронхита у крыс со САГ. Кроме того, оксидативный стресс, воспаление, гиперкоагуляция и иммунный дисбаланс, которые наблюдаются у крыс данной линии, являются патогенетической основой как для ХОБЛ, так и для АГ. Это дает возможность использовать данную линию животных в качестве экспериментальной модели сочетанной кардиопульмональной патологи, в частности АГ и ХОБЛ.
Выводы.
1. У крыс со спонтанной артериальной гипертензией линии SHR имели место морфологические изменения в бронхиальном дереве и легочной паренхиме, причиной которых могли быть метаболические и гемодинамические расстройства, характерные для ессенциальной гипертензии.
2. Выявленные сужение просвета бронхов, слизистые пробки, разрастание соединительной ткани и наличие лимфоидных инфильтратов в стенке бронхов, а также повреждение межальвеолярных перегородок могли свидетельствовать о бронхиальной обструкции и эмфизематозных изменениях.
3. Наличие у крыс со спонтанной артериальной гипертензией признаков бронхиальной обструкции, эмфизематозных изменений, периваскулярного и перибронхиального склероза, которые являются патогенетической основой для развития хронического обструктивного заболевания легких, дает возможность использовать данную линию животных в качестве экспериментальной модели для изучения сочетанной кардиопульмональной патологии.
Список литературы:
1.Березин А.Е. Хроническая обструктивная болезнь легких и кардиоваскулярный риск // Український медичний часопис. – 2009. – №2 (70). – С. 62–68.
2.Бобров В.О. Системная артериальная гипертензия при хроническх обструктивных заболеваниях легких. – К.: Здоровье, 1994. – 208 с.
3.Заноздра Н.С., Малышко Л.Н. Особеннности адаптации кислороднотранспортной системы к физическим нагрузкам у больных пограничной артериальной гипертензией // Врачеб. дело. – 1983. - №1. – С. 33–37.
4.Кароли Н.А., Орлова Е.Е., Маркова А.В. Коморбидность при хронической обструктивной болезни легких // Тер. арх. – 2008. – №3. – С. 20–23.
5.Катюхин В.Н. Сосотояние функции внешнего дыхания у больных гипертонической болезнью // Врачеб. дело. – 1988. – №6. – С. 32–35.
6.Туев А.В., Щекотов В.В. Функция внешнего дыхания оксигенации крови и содержание биогенных аминов при различных гемодинамических вариантах гипертонической болезни // Кардиология. – 1986. – №8. – С. 77–81.
7.Amagasa H, Okazaki M, Iwai T, Kobayashi S, Oguchi K. Enhancement of the coagulation system in spontaneously hypertensive and hyperlipidemic rats // J. Atheroscler. Thromb. – 2005. – Vol. 12. – P. 191–198.
8.Khraibi AA, Norman RA Jr, Dzielak DJ. Chronic immunosuppression attenuates hypertension in Okamoto spontaneously hypertensive rats // Am. J. Physiol. – 1984. – Vol. 247. – Р. 722–726.
9.Kobayashi N, DeLano FA, Schmid-Schonbein GW. Oxidative stress promotes endothelial cell apoptosis and loss of microvessels in the spontaneously hypertensive rats // Arterioscler. Thromb. Vasc. Biol. – 2005. – Vol. 25. – Р. 2114–2121.
10.Sin D.D., Man S.F. Why are patients with chronic obstructive pulmonary disease at increased risk of cardiovascular diseases? The potential role of systemic inflammation in chronic obstructive pulmonary disease // Circulation. – 2003. – Vol. 107. – P. 1514–1519.
дипломов


Оставить комментарий